Рибонуклеазни инхибитор
| Понављање богато леуцином | |||||||||
|---|---|---|---|---|---|---|---|---|---|
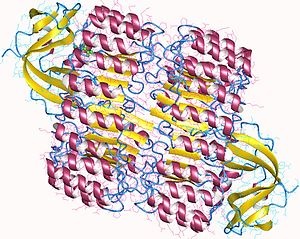
 Поглед од горе на свињски рибонуклеазни инхибитор, приказује његов облик потковице.[1] Спољашњи слој се састоји од α-хеликса, а унутрашњи од паралелни β-ланаца. Унутрашњи и спољашњи пречник су око 2.1 нм и 6.7 нм, респективно. | |||||||||
| Идентификатори | |||||||||
| Симбол | ЛРР_1 | ||||||||
| Пфам | ПФ00560 | ||||||||
| Пфам клан | ЦЛ0022 | ||||||||
| ИнтерПро | ИПР003590 | ||||||||
| СМАРТ | СМ00368 | ||||||||
| СЦОП | 1бнх | ||||||||
| СУПЕРФАМИЛY | 1бнх | ||||||||
| |||||||||
Рибонуклеазни инхибитор (РИ) је велики (~450 остатака, ~49 кДа), кисели (пИ ~4.7), протеин понављања богатих леуцином, који формира екстремно чврсте комплексе са појединим рибонуклеазама. Он је један од главних ћелијских протеина. Он сачињава ~0.1% свих ћелијских протеина по тежини, и има важну улогу у регулисању животног века РНК.[2]
РИ има изненађујућие висок садржај цистеина (~6.5%, цф. 1.7% за типичне протеине) и сензитиван је на оксидацију. РИ је исто тако богат леуцином (21.5%, у поређењу са 9% код типичних протеина) и има пропорционално нижи удео других хидрофобних остатака, посебно валина, изолеуцина, метионина, тирозина, и фенилаланина.
Структура[уреди | уреди извор]

РИ је класични протеин понављања богатог леуцином, који се састоји од наизменичних α-хеликса и β-ланаца дуж своје основе. Ови елементи секундарне структуре су омотани у закривљени, десноруки соленоид који подсећа на потковицу. Паралелни β-ланци и α-хеликси формирају унутрашњи и спољашњи зид потковице, респективно. Структура је стабилизована унутрашњим аспарагинима у бази сваког заокрета, кад ланац прелази из α-хеликса у β-раван. αβ мотив са 28 до 29 остатака се алтернативно понавља, ефективно формирајући 57-остатака дугу јединицу која кореспондира својој генетичкој структури (сваки ексон кодира 57-остатака дугу јединицу).
Везивање за рибонуклеазе[уреди | уреди извор]
Афинитет РИ за рибонуклеазе је један од највиших међу познатим протеин-протеин интеракцијама; константа дисоцијације комплекса РИ-РНазе А је фемтомоларног (фМ) реда величине под физиолошким условима, док је Кд вредност за комплекс РИ-ангиогенин мања 1 фМ. Упркос високог афинитета, РИ може да веже широк опсег РНаза А, мада оне имају релативно низак индентитет секвенци. Резултати биохемијских студија и разматрања кристалографских структура комплекса РИ-РНазе А указују на чињеницу да су интеракције превасходно електростатичке природе, као и да постоје знатне заклоњене површине.[3][4] РИ афинитет за рибонуклеазе је важан, пошто многе рибонуклеазе производе цитотоксичне и цитостатичке ефекте који су у доброј корелацији са њиховом способности везивања РИ.[5]
Рибонуклеазни инхибитори сисара немају способност везивања појединих чланова панкреасних рибонуклеаза из других врста. Специфично, на амфибијске РНазе, као што су ранпирназа и амфиназа из северних леопардских жаба, не утичу РИ сисара и уочено је да оне манифестују диференцијалну цитотоксичност за ћелије рака.[6]
Референце[уреди | уреди извор]
- ^ а б PDB: 2БНХ; Кобе Б, Деисенхофер Ј (1993). „Црyстал струцтуре оф порцине рибонуцлеасе инхибитор, а протеин wитх леуцине-рицх репеатс”. Натуре. 366 (6457): 751—6. ПМИД 8264799. дои:10.1038/366751а0.
- ^ Схапиро Р (2001). „Цyтопласмиц рибонуцлеасе инхибитор”. Метходс ин Ензyмологy. 341: 611—28. ПМИД 11582809. дои:10.1016/С0076-6879(01)41180-3.
- ^ Лее ФС, Схапиро Р, Валлее БЛ (1989). „Тигхт-биндинг инхибитион оф ангиогенин анд рибонуцлеасе А бy плацентал рибонуцлеасе инхибитор”. Биоцхемистрy. 28 (1): 225—30. ПМИД 2706246. дои:10.1021/би00427а031.
- ^ Папагеоргиоу АЦ, Схапиро Р, Ацхарyа КР (1997). „Молецулар рецогнитион оф хуман ангиогенин бy плацентал рибонуцлеасе инхибитор--ан X-раy црyсталлограпхиц студy ат 2.0 А ресолутион”. Тхе ЕМБО Јоурнал. 16 (17): 5162—77. ПМЦ 1170149
 . ПМИД 9311977. дои:10.1093/ембој/16.17.5162.
. ПМИД 9311977. дои:10.1093/ембој/16.17.5162.
- ^ Макаров АА, Илинскаyа ОН (2003). „Цyтотоxиц рибонуцлеасес: молецулар wеапонс анд тхеир таргетс”. ФЕБС Леттерс. 540 (1-3): 15—20. ПМИД 12681476. дои:10.1016/с0014-5793(03)00225-4.
- ^ Арделт W, Схоген К, Дарзyнкиеwицз З (2008). „Онцонасе анд ампхинасе, тхе антитумор рибонуцлеасес фром Рана пипиенс ооцyтес”. Цуррент Пхармацеутицал Биотецхнологy. 9 (3): 215—25. ПМЦ 2586917
 . ПМИД 18673287. дои:10.2174/138920108784567245.
. ПМИД 18673287. дои:10.2174/138920108784567245.
Литература[уреди | уреди извор]
- Кобе Б, Деисенхофер Ј (1995). „А струцтурал басис оф тхе интерацтионс бетwеен леуцине-рицх репеатс анд протеин лигандс”. Натуре. 374 (6518): 183—6. ПМИД 7877692. дои:10.1038/374183а0.
- Кобе Б, Деисенхофер Ј (1996). „Мецханисм оф рибонуцлеасе инхибитион бy рибонуцлеасе инхибитор протеин басед он тхе црyстал струцтуре оф итс цомплеx wитх рибонуцлеасе А”. Јоурнал оф Молецулар Биологy. 264 (5): 1028—43. ПМИД 9000628. дои:10.1006/јмби.1996.0694.
- Папагеоргиоу АЦ, Схапиро Р, Ацхарyа КР (1997). „Молецулар рецогнитион оф хуман ангиогенин бy плацентал рибонуцлеасе инхибитор--ан X-раy црyсталлограпхиц студy ат 2.0 А ресолутион”. Тхе ЕМБО Јоурнал. 16 (17): 5162—77. ПМЦ 1170149
 . ПМИД 9311977. дои:10.1093/ембој/16.17.5162.
. ПМИД 9311977. дои:10.1093/ембој/16.17.5162. - Сузуки M, Саxена СК, Боиx Е, Прилл РЈ, Васандани ВМ, Ладнер ЈЕ, Сунг C, Yоуле РЈ (1999). „Енгинееринг рецептор-медиатед цyтотоxицитy инто хуман рибонуцлеасес бy стериц блоцкаде оф инхибитор интерацтион”. Натуре Биотецхнологy. 17 (3): 265—70. ПМИД 10096294. дои:10.1038/7010.
- Схапиро Р, Руиз-Гутиеррез M, Цхен ЦЗ (2000). „Аналyсис оф тхе интерацтионс оф хуман рибонуцлеасе инхибитор wитх ангиогенин анд рибонуцлеасе А бy мутагенесис: импортанце оф инхибитор ресидуес инсиде версус оутсиде тхе C-терминал "хот спот"”. Јоурнал оф Молецулар Биологy. 302 (2): 497—519. ПМИД 10970748. дои:10.1006/јмби.2000.4075.
- Бретсцхер ЛЕ, Абел РЛ, Раинес РТ (2000). „А рибонуцлеасе А вариант wитх лоw цаталyтиц ацтивитy бут хигх цyтотоxицитy”. Тхе Јоурнал оф Биологицал Цхемистрy. 275 (14): 9893—6. ПМИД 10744660. дои:10.1074/јбц.275.14.9893.
- Yаковлев ГИ, Миткевицх ВА, Макаров АА (2006). „Рибонуцлеасе инхибиторс”. Молецулар Биологy. 40 (6): 867—874. дои:10.1134/С0026893306060045.[мртва веза]
