Тиол
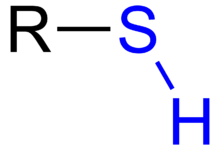
У органској хемији, тиол је органосумпорно једињење које садржи за угљеник везану сулфхидрилну (–C–SH или R–SH) групу (где R означава алкан, алкен, или другу која садржи атоме угљеника). –SH функционална група се назива било тиолном или сулфхидрилном групом. Тиоли су сумпорни аналози алкохола (тј. сумпор заузима место кисеоника у хидроксилној групи алкохола), а реч је мешавина „тио-” и „алкохола”, при чему прва реч потиче из грчког θεῖον – теион = сумпор.[1]
Многи тиоли имају јак мирис који подсећа на бели лук или трула јаја. Тиоли се користе као одоранти који помажу у детекцији природног гаса, који у чистом облику нема мириса, и „мирис природног плина” последица је мириса тиола који се користи као одоранс. Тиоли се често називају меркаптанима.[2][3] Тај термин је изведен из лат. mercurium captans (хватање живе),[4] јер тиолна група формира јаке везе са једињењима живе, увео је Вилијам Кристофер Зеисе 1832.[5][6]
Структура и везивање[уреди | уреди извор]
Тиоли структуре Р–СХ називају се алканетиоли или алкил-тиоли, у којима је алкил група (Р) везана за сулфхидрил групу (СХ).[7] Тиоли и алкохоли имају сличну молекулску структуру. Главна разлика је величина халкогенида. Дужина C–S везе је око 180 пикометара, а C–S–H угао је око 90°. Водонично везивање између индивидуалних тиолних група је слабо, и главна кохезивна сила су ван дер Валсове интеракције између високо поларизаблних дивалентних сумпорних центара. S−H веза је много слабија од O–H везе, што се одражава у њиховој енергији дисоцијације везе (БДЕ). За CH3S–H БДЕ износи 366 kJ/mol, док је за CH3O–H БДЕ 440 kJ/mol.[8]
Услед мале разлике у електронегативности између сумпора и водоника, S–H веза је мање поларна него хидроксилна група. Тиоли имају мање диполне моменте од кореспондирајућих алкохола.
Номенклатура[уреди | уреди извор]
Постоји неколико начина за именовање алкилтиола:
- Суфикс –тиол додат је имену алкана. Овај начин је готово идентичан именовању алкохола и користи је IUPAC, нпр. CH3SH би био метанетиол .
- Термин меркаптан замјењује алкохол у имену еквивалентног алкохолног једињења. Пример: CH3SH би био метил-меркаптан, баш као што се CH3OH назива метилним алкохолом.
- Термин сулфхидрил– или меркапто– користи се као префикс, нпр. меркаптопурин.
Физичке особине[уреди | уреди извор]
Мирис[уреди | уреди извор]
Многи тиоли имају јаке мирисе налик мирису белог лука. Мириси тиола, посебно оних ниске молекулске тежине, често су јаки и одбојни. Спреј од твора састоји се углавном од нискомолекуларних тиола и деривата.[9][10][11][12][13] Ова једињења детектује људски нос у концентрацији од само 10 делова на милијарду.[14] Људски зној садржи (R)/(S)-3-метил-3-меркапто-1-ол (МСХ), који се детектује у 2 дела на милијарду и има воћни мирис сличан луку. (Метилтио) метантиол (MeSCH2SH; MTMT) је испарљиви тиол са јаким мирисом, који се такође детектује у деловима на милијарду, а који је присутан у урину мушких мишева. Ловренс C. Кац и његови сарадници су показали да МТМТ функционише као семиохемикалија, активирајући одређене олфакторне сензорне неуроне миша, привлачећи женске мишева.[15] Показало се да је бакар неопходан за специфични мирисни рецептор миша, МОР244-3, који је високо респонсиван на МТМТ, као и на разне друге тиоле и сродна једињења.[16] Идентификован је људски мирисни рецептор ОР2Т11 који је у присуству бакра веома респонсиван на гасне задахе (види испод) етантиол и т-бутил меркаптан као и на друге тиоле мале молекулске тежине, укључујући алил меркаптан који се налази у људском задаху од белог лука и циклични сулфид тиетан са јаким мирисом.[17]
Тиоли су такође одговорни за класу винских задаха изазваних ненамерном реакцијом сумпора и квасца, као и „неугодним“ мирисом пива које је било изложено ултраљубичастој светлости.
Нису сви тиоли непријатних мириса. На пример, фуран-2-илметанетиол доприноси ароми пржене кафе, док је грејпфрут меркаптан, монотерпеноидни тиол, одговоран за карактеристичан мирис грејпфрута. Ефекат потоњег једињења присутан је само у ниским концентрацијама. Чисти меркаптан има непријатан задах.
Од дистрибутера природног гаса се очекује да додају тиоле, првобитно етантиол, природном гасу (који природно нема мириса). Тај захтев је постао мандаторан након смртоносне експлозије школе Њу Лондон у Новом Лондону у Тексасу 1937. године. Многи дистрибутери гаса су одоризирали гас и пре овог догађаја. Већина употребљених одорних гасова тренутно садржи смеше меркаптана и сулфида, са т-бутил меркаптаном као главним састојком мириса у природном гасу и етантиолом у утечњом нафтном гасу (ТНГ, пропан).[18] У ситуацијама у којима се тиоли користе у комерцијалној индустрији, као што су цистерне са течним нафтним гасом и системи за руковање великих количина, оксидациони катализатор се користи за неутралисање мириса. Катализатор на бази оксидације бакра неутралише испарљиве тиоле и претвара их у инертне производе.
Тачке кључања и растворљивост[уреди | уреди извор]
Тиоли показују мали степен повезаности водоничним везивањем, како са молекулима воде, тако и међу собом. Стога имају ниже тачке кључања и мање су растворљиви у води и другим поларним растварачима од алкохола сличне молекулске тежине. Из тог разлога, тиоли и њихове кореспондирајуће изомери сулфидне функционалне групе имају сличне карактеристике растворљивости и тачке кључања, док то не важи за алкохоле и њихове одговарајуће изомерне етре.
Везивање[уреди | уреди извор]
Веза S-H у тиолима је слаба у поређењу са O-H везом у алкохолима. За CH3X−H, енталпије веза су 365,07±2,1 кцал/мол за X = S и 440,2±3,0 кцал/мол за X = O.[19] Абстракција атома водоника из тиола даје тиилни радикал формуле RS•, где је R = алкил или арил.
Реакције[уреди | уреди извор]
- Стварање соли
Као што је водоник-сулфид киселији од воде, меркаптани су киселији од алкохола и реагирају с јаким базама раствореним у води, дајући соли. Као и натријум сулфид, ове соли у воденом раствору знатно се хидролизирају.
- RSH + NaOH RSNa + H2O
Соли тешких метала, као соли олова, живе, бакра, кадмијума и сребра, нерастворне су у води.
- Оксидација у дисулфиде

Раствори натријум хипохалогенида оксидују на собној температури меркаптане до сулфида.
- 2 RSH + I2 + 2 NaOH → RSSR + 2 NaI + 2 H2O
Ако се употреби стандардни раствор јода, ова реакција повољна је за квантитативно одређивање меркаптана. Лако се оксидују на ваздуху, посебно у присуству амонијака.
Докторов процес за уклањање неугодног мириса бензина зависи од реакције меркаптана у дисулфиде, који имају слабији мирис, помоћу раствора натријум плумбита и мале количине сумпора.
- 2 RSH + Na2PbO2 → Pb(SR)2 + 2 NaOH
- Pb(SR)2 + S → PbS + (RS)2
Докторов раствор се регенерише провођењем ваздуха кроз врући раствор.
- PbS + 4 NaOH + 2 O2 → Na2PbO2 + Na2SO4 + 2 H2O
Докторов раствор се може такође употребити као доказ сулфхидрилне групе. Стварање црног оловног сулфида знак је позитивне реакције. Оксидације сулфхидрилне групе из цистеинског дела протеинских молекула у дисулфидне групе и редукција дисулфида у сулфхидрил има значајну улогу у биолошким процесима.
- Оксидација у сулфонске киселине
Ова реакција обично се одвија греањем меркаптана или соли, као што је оловни меркаптид, с концентрованом азотном киселином.
- RSH + 3 [O] (HNO3) → RSO3H
- (RS)2Pb + 6 [O] (HNO3) → (RSO3)2Pb
- Стварање естера

Кад примарни тиоли реагују с карбоксилним киселинама, настају тиоестри и вода, пре него естрии и водоник-сулфид.
- RCOOH + HSR RCOSR + H2O
Ова реакција била је основ за претпоставку да се, при естерификацији примарних алкохола с киселинама, хидроксилна група отцепљује пре с киселине него с алкохола, што је доказано помоћу изотопа О18.
Меркатани реагују такође с халогенидима киселина, дајући тиоестере.
- RSH + ClCOR → RSCOR + HCl
За разлику од хидроксилне групе, меркапто група се не замењује лако. Фосфорни триклорид нпр. реагује формирајући тиоестер.
- RSH + PCl3 → RSPCl2 + HCl
- Настајање тиоацетала
Тиоли лако реагују с алдехидима и кетонима уз хлороводоник или цинк јодид, формирајући тиоацетале.
- RCHO + 2 R`SH → RCH(SR`)2 + H2O
- R2CO + 2 R`SH → R2C(SR`)2 + H2O
Ова једињења су много стабилнија на хидролизу киселином од ацетала, али се алдехид или кетон могу регенерирати хидролизом уз живин(II) оксид.
Примери тиола[уреди | уреди извор]
- Метантиол – CH3SH [метил меркаптан]
- Етантиол – C2H5 SH [етил меркаптан]
- 1-Пропанетиол – C3H7SH [n - пропил меркаптан]
- 2-пропантиол – CH3CH(SH)CH3 [2C3 меркаптан]
- Алил меркаптан – CH2=CHCH2SH [2-пропентиол]
- Бутантиол - C4H9SH [n - бутил меркаптан]
- Терц- бутил меркаптан – (CH3)3CSH [t - бутил меркаптан]
- Пентантиол – C5H11SH [пентил меркаптан]
- Тиофенол – C6H5SH
- Димеркаптосукцинска киселина
- Тиосирћетна киселина
- Коензим А
- Глутатион
- Металотионеин
- Цистеин
- 2-Меркаптоетанол
- Дитиотреитол / дитхиоерyтхритол (пар епимера)
- 2-Меркаптоиндол
- Грапефруит меркаптан
- Фуран-2-илметантиол
- 3-Меркаптопропан-1,2-диол
- 3-Меркапто-1-пропансулфонска киселина
- 1-хексадекантиол
- Пентахлоробензентиол
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ θεῖον Архивирано 2017-05-10 на сајту Wayback Machine, Хенрy Георге Лидделл, Роберт Сцотт, А Греек–Енглисх Леxицон
- ^ Патаи, Саул, ур. (1974). Тхе цхемистрy оф тхе тхиол гроуп. Лондон: Wилеy. ИСБН 978-0-471-66949-4.
- ^ Р. Ј. Цремлyн (1996). Ан Интродуцтион то Органосулфур Цхемистрy. Цхицхестер: Јохн Wилеy анд Сонс. ИСБН 978-0-471-95512-2.
- ^ Дицтионарy.цом: мерцаптан Архивирано 2012-11-13 на сајту Wayback Machine
- ^ Oxford American Dictionaries (Mac OS X Leopard).
- ^ See:
- Zeise, William Christopher (1834). „Mercaptanet, med bemaerkninger over nogle andre nye producter af svovelvinsyresaltene, som og af den tunge vinolie, ved sulfureter” [Mercaptan, with remarks on some other new products of salts of ethyl hydrogen sulfate as well as of heavy oil of wine, by means of hydrogen sulfide]. Kongelige Danske Videnskabers Selskabs Skrifter. 4th series (на језику: дански). 6: 1—70. On p. 13 the word "mercaptan" is coined.
- German translation: Zeise, W. C. (1834). „Das Mercaptan, nebst Bermerkungen über einige neue Producte aus der Einwirkung der Sulfurete auf weinschwefelsaure Salze und auf das Weinöl” [Mercaptan together with comments on some new products from the effect of hydrogen sulfide on salts of ethyl sulfate ((C2H5)HSO4) and heavy oil of wine (a mixture of diethyl sulfate, diethyl sulfite, and polymerized ethylene)]. Annalen der Physik und Chemie. 2nd series (на језику: немачки). 31 (24): 369—431. From p. 378: " … nenne ich den vom Quecksilber aufgenommenen Stoff Mercaptum (von: Corpus mercurio captum) … " ( … I name the substance [that is] absorbed by mercury "mercaptum" (from: the body (substance) [that] has been absorbed by mercury) … )
- German translation is reprinted in:Zeise, W. C. (1834). „Das Mercaptan, nebst Bemerkungen über einige andere neue Erzeugnisse der Wirkung schwefelweinsaurer Salze, wie auch des schweren Weinöls auf Sulphurete”. Journal für Praktische Chemie. 1 (1): 257—268, 345—356, 396—413, 457—475. doi:10.1002/prac.18340010154.
- Summarized in: Zeise, W. C. (1834). „Ueber das Mercaptan” [On mercaptan]. Annalen der Pharmacie. 11 (1): 1—10. doi:10.1002/jlac.18340110102. Архивирано из оригинала 2015-03-20. г.
- Zeise, William Christopher (1834). „Sur le mercaptan; avec des observations sur d'autres produits resultant de l'action des sulfovinates ainsi que de l'huile de vin, sur des sulfures metalliques” [On mercaptan; with observations on other products resulting from the action of sulfovinates [typically, ethyl hydrogen sulfate] as well as oil of wine [a mixture of diethylsulfate and ethylene polymers] on metal sulfides]. Annales de Chimie et de Physique. 56: 87—97. Архивирано из оригинала 2015-03-20. г. "Mercaptan" (ethyl thiol) was discovered in 1834 by the Danish professor of chemistry William Christopher Zeise (1789–1847). He called it "mercaptan", a contraction of "corpus mercurio captans" (mercury-capturing substance) [p. 88], because it reacted violently with mercury(II) oxide ("deutoxide de mercure") [p. 92].
- The article in Annales de Chimie et de Physique (1834) was translated from the German article: Zeise, W. C. (1834). „Das Mercaptan, nebst Bemerkungen über einige neue Producte aus der Einwirkung der Sulfurete auf weinschwefelsaure Salze und auf das Weinöl”. Annalen der Physik und Chemie. 107 (27): 369—431. Bibcode:1834AnP...107..369Z. doi:10.1002/andp.18341072402. Архивирано из оригинала 2015-03-20. г.
- ^ „Alkanethiols”. Royal Society of Chemistry. Приступљено 4. 9. 2019.
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Andersen K. K.; Bernstein D. T. (1978). „Some Chemical Constituents of the Scent of the Striped Skunk (Mephitis mephitis)”. Journal of Chemical Ecology. 1 (4): 493—499. S2CID 9451251. doi:10.1007/BF00988589.
- ^ Andersen K. K., Bernstein D. T.; Bernstein (1978). „1-Butanethiol and the Striped Skunk”. Journal of Chemical Education. 55 (3): 159—160. Bibcode:1978JChEd..55..159A. doi:10.1021/ed055p159.
- ^ Andersen K. K.; Bernstein D. T.; Caret R. L.; Romanczyk L. J., Jr. (1982). „Chemical Constituents of the Defensive Secretion of the Striped Skunk (Mephitis mephitis)”. Tetrahedron. 38 (13): 1965—1970. doi:10.1016/0040-4020(82)80046-X.
- ^ Wood W. F.; Sollers B. G.; Dragoo G. A.; Dragoo J. W. (2002). „Volatile Components in Defensive Spray of the Hooded Skunk, Mephitis macroura”. Journal of Chemical Ecology. 28 (9): 1865—70. PMID 12449512. S2CID 19217201. doi:10.1023/A:1020573404341.
- ^ William F. Wood. „Chemistry of Skunk Spray”. Dept. of Chemistry, Humboldt State University. Архивирано из оригинала 8. 10. 2010. г. Приступљено 2. 1. 2008.
- ^ Aldrich, T.B. (1896). „A Chemical Study of the Secretion of the Anal Glands of Mephitis mephitiga (Common Skunk), with Remarks on the Physiological Properties of This Secretion”. J. Exp. Med. 1 (2): 323—340. PMC 2117909
 . PMID 19866801. doi:10.1084/jem.1.2.323.
. PMID 19866801. doi:10.1084/jem.1.2.323.
- ^ Lin, Dayu; Zhang, Shaozhong; Block, Eric; Katz, Lawrence C. (2005). „Encoding social signals in the mouse main olfactory bulb”. Nature. 434 (7032): 470—477. Bibcode:2005Natur.434..470L. PMID 15724148. S2CID 162036. doi:10.1038/nature03414.
- ^ Duan, Xufang; Block, Eric; Li, Zhen; Connelly, Timothy; Zhang, Jian; Huang, Zhimin; Su, Xubo; Pan, Yi; et al. (2012). „Цруциал роле оф цоппер ин детецтион оф метал-цоординатинг одорантс”. Проц. Натл. Ацад. Сци. У.С.А. 109 (9): 3492—3497. Бибцоде:2012ПНАС..109.3492Д. ПМЦ 3295281
 . ПМИД 22328155. дои:10.1073/пнас.1111297109.
. ПМИД 22328155. дои:10.1073/пнас.1111297109.
- ^ „Цоппер кеy то оур сенситивитy то роттен еггс' фоул смелл”. цхемистрywорлд.цом. Архивирано из оригинала 10. 5. 2017. г. Приступљено 3. 5. 2018.
- ^ Робертс, Ј. С., ур. (1997). Кирк-Отхмер Енцyцлопедиа оф Цхемицал Тецхнологy. Wеинхеим: Wилеy-ВЦХ.
- ^ Луо, Y.Р.; Цхенг, Ј.П. (2017). „Бонд Диссоциатион Енергиес”. Ур.: Ј. Р. Румбле. Хандбоок оф Цхемистрy анд Пхyсицс. ЦРЦ Пресс.
Спољашње везе[уреди | уреди извор]
- Примена, особине, и синтеза тиола
- Меркаптан
- Шта је меркаптан?
- Mercaptans (or Thiols) at The Periodic Table of Videos (University of Nottingham)
- What Is the Worst Smelling Chemical? Архивирано на сајту Wayback Machine (6. јун 2011), by About Chemistry.

