Деградација масних киселина
Деградација масних киселина је процес којим се масне киселине разлажу у њихове метаболите, и на крају се формира ацетил-КоА, који је улазни молекул за циклус лимунске киселине, главни извор снабдевања енергијом код животиња. Процес се састоји из три главна корака:
- Липолиза и ослобађање из адиспозног ткива
- Активација и транспорт у митохондрије
- β-оксидација
Липолиза и ослобађање[уреди | уреди извор]
Иницијално у процесу деградације, масне киселине су ускладиштене у масном ткиву (адипоцитима). Разлагање те масти се назива липолиза.[1][2] Продукти липолизе, слободне масне киселине, се ослобађају у крвоток и циркулишу кроз тело. Током разлагања триацилглицерола у масне киселине, више од 75% масних киселине се конвертује назад триацилглицерол, што је природни механизам конзервације енергије, чак и у случајевима гладовања и вежбања.
Активација и транспорт у митохондрије[уреди | уреди извор]
Масне киселине морају да буду активиране пре него што се могу пренети у митохондрије, где долази до оксидације масних киселина. Овај процес се одвија у два ступња који су катализовани ензимом синтетаза маснокиселинског ацил-КоА.[3][4][5]
Формирање активиране тиоестерске везе[уреди | уреди извор]
Ензим прво катализује нуклеофилни напад на α-фосфат АТП молекул чиме се формира пирофосфат и ацилни ланац везан за АМП. Следећи корак је формирање активиране тиоестарске везе између маснокиселинског ланца и конезима А.
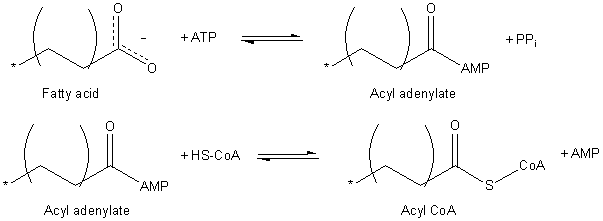
Балансирана једначина је:
- RCOO− + CoA + ATP → RCO-CoA + AMP + PPi + 2H+
Ова двоступна реакција је слободно реверзибилна и њен еквилибријум лежи у близини 1. Да би реакција напредовала, она мора да буде спрегнута са реакцијом јаке егзергонске хидролизе: ензим неорганска пирофосфатаза одваја пирофосфат са АТП, настају два фосфатна јона, и конзумира се један молекул воде. Нето реакција је:
- RCOO− + CoA + ATP + H2O → RCO-CoA + AMP + 2Pi + 2H+
Транспорт у митохондријску матрицу[уреди | уреди извор]
Унутрашња митохондријска мембрана је непропусна за масне киселине и специјализовани карнитински преносни систем обавља операцију транспорта активираних масних киселина из цитозола у митохондрије.
Након активације, ацил КоА се транспортују у митохондријску матрицу. То се одвија путем серије једноставних корака:
- Ацил КоА се коњугује са карнитином посредством карнитин ацилтрансферазе I (палмитоилтрансферазе I) лоциране на спољашњој митохондријској мембрани
- Ацил карнитин преноси на унутрашњу старну транслоказа
- Ацил карнитин (као што је палмитоилкарнитин) се конвертује у ацил КоА посредством карнитин ацилтрансферазе (палмитоилтрансферазе II) лоциране на унутрашњој митохондријској мембрани. Ослобођени карнитин се враћа у цитозол.
Важно је да се напомене да карнитин ацилтрансферазе I подлеже алостерној инхибицији дејством малонил-КоА, једним од интермедијера биосинтезе масне киселине, чиме се спречава беспотребно циркулисање између бета оксидације и синтезе масних киселина.
Митохондријска оксидација масних киселина се одвија у три ступња: 1. β-оксидација: конверзија масних киселина у двоугљеничне ацетил КоА јединице. 2. улаз ацетил КоА у ТЦА циклус ради ослобађања енергије. 3. електронски транспортни ланац у митохондријама.
β-оксидација[уреди | уреди извор]
β-оксидација масних киселина се одвија у митохондријама у пет понављајућих корака:
- Активација помоћу АТП
- Оксидација помоћу ФАД,
- Хидрација,
- Оксидација помоћу НАД+,
- Тиолиза,
- Финални продукат је ацетил-КоА, који је улазни молекул за циклус лимунске киселине.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Дунцан, Робин Е.; Ахмадиан, Марyам; Јаwорски, Катхy; Саркади-Нагy, Есзтер; Сул, Хеи Соок (август 2007). „Регулатион оф Липолyсис ин Адипоцyтес”. Аннуал Ревиеw оф Нутритион. 27 (1): 79—101. дои:10.1146/аннурев.нутр.27.061406.093734.
- ^ Ниелсен, ТС; Јессен, Н; Јøргенсен, ЈО; Мøллер, Н; Лунд, С (јун 2014). „Диссецтинг адипосе тиссуе липолyсис: молецулар регулатион анд имплицатионс фор метаболиц дисеасе.”. Јоурнал оф молецулар ендоцринологy. 52 (3): Р199—222. ПМИД 24577718. дои:10.1530/ЈМЕ-13-0277.
- ^ PDB: 1В26; Хисанага Y, Аго Х, Накагаwа Н, Хамада К, Ида К, Yамамото M, Хори Т, Арии Y, Сугахара M, Курамитсу С, Yокоyама С, Миyано M (јул 2004). „Струцтурал басис оф тхе субстрате-специфиц тwо-степ цаталyсис оф лонг цхаин фаттy ацyл-ЦоА сyнтхетасе димер”. Ј. Биол. Цхем. 279 (30): 31717—26. ПМИД 15145952. дои:10.1074/јбц.М400100200.
- ^ Соупене Е, Куyперс ФА (мај 2008). „Маммалиан лонг-цхаин ацyл-ЦоА сyнтхетасес”. Еxп. Биол. Мед. (Маywоод). 233 (5): 507—21. ПМЦ 3377585
 . ПМИД 18375835. дои:10.3181/0710-МР-287.
. ПМИД 18375835. дои:10.3181/0710-МР-287.
- ^ Бæкдал Т, Сцхјерлинг ЦК, Хансен ЈК, Кнудсен Ј (1997). „Аналyсис оф лонг-цхаин ацyл-Цоензyме А естерс”. Ур.: Цхристие W. Адванцес ин Липид Метходологy (Тхрее изд.). Аyр, Сцотланд: Оилy Пресс. стр. 109—131. ИСБН 978-0-9514171-7-1.
