Осмотски притисак
Осмотски притисак је хидростатски притисак потребан да би се спречио помак воде изазван осмоларним градијентом: што је већа разлика у осмоларности, већи је и осмотски притисак.
Осмотски притисак је притисак раствора на полупропусну мембрану како би се спречило да вода тече унутра кроз мембрану. Тоничност је мера овог притиска. Ако је концентрација растворених супстанци на обе стране мембране једнака, тада нема тенденције кретања воде преко мембране и нема осмотског притиска. Раствори су међусобно изотонични. Обично је на једној страни мембране већа концентрација растворених супстанци од друге.[1][2]
Раствор који садржи више растворених супстанци него жива ћелија дефинише се као хипертонични; ако се ћелија налази у хипертоничном раствору вода ће излазити из ћелије у околину и ћелија ће се смањити. Хипотонични раствор има мању концентрацију растворених супстанци него ћелија, па ћелија у хипотоничном окружењу набубри, а понекад се чак и распадне од прекомерног бубрења.
Дифузија наспрам осмозе
[уреди | уреди извор]
Дифузија је кретање честица из подручја веће концентрације у подручје мање концентрације. На пример, ако додате шећер у воду, шећер ће се дифундирати кроз воду све док концентрација шећера у води не буде константна у целом раствору. Још један пример дифузије је како се мирис парфема шири просторијом.
Током осмозе, као и код дифузије, постоји тенденција честица да траже исту концентрацију кроз раствор. Међутим, честице могу бити превелике да пређу полупропусну мембрану која раздваја регионе раствора, па се вода креће преко мембране. Ако имате раствор шећера на једној страни полупропусне мембране, а чисту воду на другој страни мембране, увек ће бити притиска на воденој страни мембране да покуша разблажити раствор шећера.
Мали јони и молекули могу да пређу полупропусну мембрану, па се растворене супстанце попут малих јона (На + , Цл - ) понашају слично као кад би се појавила једноставна дифузија.[1]
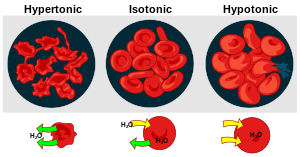
Хипертоничност, изотоничност и хипотоничност
[уреди | уреди извор]Тоничност раствора у односу једни на друге може се изразити као хипертонична, изотонична или хипотонична. Ефекат различитих спољних концентрација растворених супстанци на црвене крвне ћелије служи као добар пример за хипертонично, изотонично и хипотонично решење.[1]
Хипертонично решење или хипертоничност
[уреди | уреди извор]Када је осмотски притисак раствора изван крвних зрнаца већи од осмотског притиска унутар црвених крвних зрнаца, раствор је хипертоничан . Вода унутар крвних зрнаца излази из ћелија у покушају да изједначи осмотски притисак, што доводи до смањења или стварања ћелија.[1]
Изотонично решење или изотоничност
[уреди | уреди извор]Када је осмотски притисак изван црвених крвних зрнаца једнак притиску унутар ћелија, раствор је изотоничан у односу на цитоплазму. Ово је уобичајено стање црвених крвних зрнаца у плазми.[1]
Хипотонично решење или хипотоничност
[уреди | уреди извор]Када решење изван црвених крвних зрнаца има мању осмотски притисак него цитоплазми на црвених крвних зрнаца, решење је хипотонична у односу на ћелије. Ћелије узимају воду у покушају да изједначе осмотски притисак, узрокујући да набрекну и потенцијално пукну.[1]
Види још
[уреди | уреди извор]Спољашње везе
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ а б в г д ђ „Разумети осмотски притисак и тоничност”. Разумети осмотски притисак и тоничност (на језику: српски). 2019-01-18. Приступљено 2021-11-10.
- ^ Voet, Donald (2002). Fundamentals of biochemistry upgrade. Judith G. Voet, Charlotte W. Pratt ([Rev. ed.] изд.). New York: Wiley. ISBN 0-471-41759-9. OCLC 46538398.
