Бојл—Мариотов закон — разлика између измена
м r2.7.1) (Робот додаје: id:Hukum Boyle |
м r2.7.1) (Робот додаје: eu:Boyle-Mariotteren legea |
||
| Ред 50: | Ред 50: | ||
[[es:Ley de Boyle-Mariotte]] |
[[es:Ley de Boyle-Mariotte]] |
||
[[eo:Leĝo de Boyle]] |
[[eo:Leĝo de Boyle]] |
||
[[eu:Boyle-Mariotteren legea]] |
|||
[[fa:قانون بویل]] |
[[fa:قانون بویل]] |
||
[[fr:Loi de Boyle-Mariotte]] |
[[fr:Loi de Boyle-Mariotte]] |
||
Верзија на датум 23. септембар 2011. у 18:00
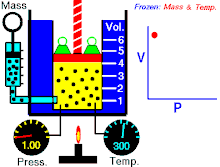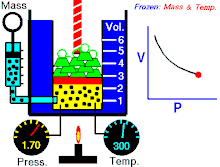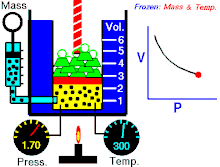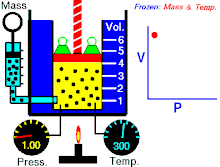
Бојл-Мариотов закон (негде познат као и Бојлов закон) је један од закона гасова. Име је добио по ирском природњаку Роберту Бојлу[1] и француском физичару Едму Мариоту. Овај закон је применљив је на гасовита тела која се понашају попут идеалних гасова.[2][3] Закон гласи:
На константној температури и непромењеној количини гаса, производ притиска и запремине је константан.[2]
То значи за колико пута повећамо притисак толико пута ћемо смањити запремину. Процеси који се дешавају на константним темпрературама су изотермски процеси.
Извођење закона
Овај закон је изведен из основне једначине молекулско кинетичке теорије гасова.
где је: - притисак, - концентрација гаса, - средња кинетичка енергија гаса.
Целу једначину помножимо са и добијамо, пошто је
.
Међутим главни услови за овај закон је да су: , . Значи да је производ притиска и запремине такође једнак константи:
, или
Бојл-Мариотов закон има велику примену (рецимо код роњења).
Литература
- ^ „The Boyle Papers, BP 9, fol. 75v-76r”.
- ^ а б Levine, Ira N. (2009). Physical chemistry. New York: McGraw-Hill. ISBN 0-07-253862-7.
- ^ John B. West (2005). „Robert Boyle’s landmark book of 1660 with the first experiments on rarified air”. J Appl Physiol. 98: 31—39.











