Dihidroorotat dehidrogenaza — разлика између измена
мНема описа измене |
мНема описа измене |
||
| Ред 58: | Ред 58: | ||
{{FixBunching|end}} |
{{FixBunching|end}} |
||
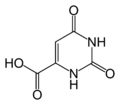
'''Dihidroorotat dehidrogenaza''' ({{EC broj-lat| 1.3.3.1}}) je [[enzim]] koji katalizuje četvrti korak u ''de novo'' [[biosinteza pirimidina| biosintezi pirimidina]].<ref name="VoetBiochemistry3rd">{{VoetBiochemistry3rd}}</ref> Ona pretvara [[dihidroorotat]] u [[orotat]] |
'''Dihidroorotat dehidrogenaza''' ({{EC broj-lat| 1.3.3.1}}) je [[enzim]] koji katalizuje četvrti korak u ''de novo'' [[biosinteza pirimidina| biosintezi pirimidina]].<ref name="VoetBiochemistry3rd">{{VoetBiochemistry3rd}}</ref><ref>{{cite book |author=Barry Steven Selinsky |title=Membrane Protein Protocols: Expression, Purification, and Characterization (Methods in Molecular Biology (Clifton, N.J.), V.228.) |publisher=Humana Press |location=Totowa, NJ |year=2003 |isbn=1-58829-124-3 |chapter=2. Dihydroorotate Dehydrogenase of Escherichia coli |doi=10.1385/1-59259-400-X:11 |pages=11-21 |accessdate=}}</ref> Ona pretvara [[dihidroorotat]] u [[orotat]]: |
||
: (S)-dihidroorotat + O<sub>2</sub> <math>\rightleftharpoons</math> orotate + H<sub>2</sub>O<sub>2</sub> |
: -{(S)}--dihidroorotat + O<sub>2</sub> <math>\rightleftharpoons</math> orotate + -{H<sub>2</sub>O<sub>2</sub>}- |
||
<gallery> |
<gallery> |
||
| Ред 70: | Ред 70: | ||
== Kliničko značenje == |
== Kliničko značenje == |
||
Za anti-upalni lek [[leflunomid]] je pokazano da inhibira -{DHODH}-. Ljudska -{DHODH}- ima dva domena: alfa/beta-barel domen koji sadrži aktivne stranice i alfa-spiralni domen koje formira otvaranje tunela koji vodi do aktivnog mesta<ref name="Rowland">{{cite journal | author = Rowland P, Björnberg O, Nielsen FS, Jensen KF, Larsen S | title = The crystal structure of Lactococcus lactis dihydroorotate dehydrogenase A complexed with the enzyme reaction product throws light on its enzymatic function | journal = Protein Sci. | volume = 7 | issue = 6 | pages = 1269–79 | year = 1998 | month = June | pmid = 9655329 | pmc = 2144028 | doi = 10.1002/pro.5560070601| url = http://www.proteinscience.org/cgi/content/abstract/7/6/1269 }}</ref>. Poznato je da se leflunomid vezuje u ovom tunelu.<ref name="pmid10673429">{{cite journal | author = Liu S, Neidhardt EA, Grossman TH, Ocain T, Clardy J | title = Structures of human dihydroorotate dehydrogenase in complex with antiproliferative agents | journal = Structure | volume = 8 | issue = 1 | pages = 25–33 | year = 2000 | month = January | pmid = 10673429 | doi = 10.1016/S0969-2126(00)00077-0 | url = }}</ref> Leflunomid se koristi za lečenje [[reumatoidni artritis|reumatoidnog artritisa]] i [[psorijaza|psorijaze]].<ref name="Foye">{{ |
Za anti-upalni lek [[leflunomid]] je pokazano da inhibira -{DHODH}-. Ljudska -{DHODH}- ima dva domena: alfa/beta-barel domen koji sadrži aktivne stranice i alfa-spiralni domen koje formira otvaranje tunela koji vodi do aktivnog mesta<ref name="Rowland">{{cite journal | author = Rowland P, Björnberg O, Nielsen FS, Jensen KF, Larsen S | title = The crystal structure of Lactococcus lactis dihydroorotate dehydrogenase A complexed with the enzyme reaction product throws light on its enzymatic function | journal = Protein Sci. | volume = 7 | issue = 6 | pages = 1269–79 | year = 1998 | month = June | pmid = 9655329 | pmc = 2144028 | doi = 10.1002/pro.5560070601| url = http://www.proteinscience.org/cgi/content/abstract/7/6/1269 }}</ref>. Poznato je da se leflunomid vezuje u ovom tunelu.<ref name="pmid10673429">{{cite journal | author = Liu S, Neidhardt EA, Grossman TH, Ocain T, Clardy J | title = Structures of human dihydroorotate dehydrogenase in complex with antiproliferative agents | journal = Structure | volume = 8 | issue = 1 | pages = 25–33 | year = 2000 | month = January | pmid = 10673429 | doi = 10.1016/S0969-2126(00)00077-0 | url = }}</ref> Leflunomid se koristi za lečenje [[reumatoidni artritis|reumatoidnog artritisa]] i [[psorijaza|psorijaze]].<ref name="Foye">{{FoyePrinciplesMedChem5th |pages=785-6}}</ref><ref name="Goodman_Gilman">{{GoodmanGilman11th |chapter=Chapter 52. Immunosuppressants, tolerogens, and immunostimulants; Immunostimulation}}</ref> |
||
Mutacije ovog gena su pokazane da uzrokuju [[Milerov sindrom]] <ref name="pmid19915526">{{cite journal | author = Ng SB, Buckingham KJ,Lee C, Bigham AW, Tabor HK, Dent KM, Huff CD, Shannon PT, Jabs EW, Nickerson DA, Shendure J, Bamshad MJ | title = Exome Sequencing identifies the cause of a mendelian disorder | journal = Nature Genetics | volume = 42 | issue = 1 | pages = 30–35 | year = 2009 | month = December | pmid = 19915526 | }}</ref> koji je isto tako poznat kao -{Genee-Wiedemann}- sindrom, -{Wildervanck-Smith}- sindrom ili [[post aksijalni akrofacijalni distosis]] (-{POADS}-). |
Mutacije ovog gena su pokazane da uzrokuju [[Milerov sindrom]] <ref name="pmid19915526">{{cite journal | author = Ng SB, Buckingham KJ,Lee C, Bigham AW, Tabor HK, Dent KM, Huff CD, Shannon PT, Jabs EW, Nickerson DA, Shendure J, Bamshad MJ | title = Exome Sequencing identifies the cause of a mendelian disorder | journal = Nature Genetics | volume = 42 | issue = 1 | pages = 30–35 | year = 2009 | month = December | pmid = 19915526 | }}</ref> koji je isto tako poznat kao -{Genee-Wiedemann}- sindrom, -{Wildervanck-Smith}- sindrom ili [[post aksijalni akrofacijalni distosis]] (-{POADS}-). |
||
Верзија на датум 17. август 2010. у 22:54
| Dihidroorotat oksidaza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||||
| EC broj | 1.3.3.1 | ||||||||
| CAS broj | 9029-03-2 | ||||||||
| Baze podataka | |||||||||
| IntEnz | IntEnz pregled | ||||||||
| BRENDA | BRENDA pristup | ||||||||
| ExPASy | NiceZyme pregled | ||||||||
| KEGG | KEGG pristup | ||||||||
| MetaCyc | metabolički put | ||||||||
| PRIAM | profil | ||||||||
| Strukture PBP | RCSB PDB PDBe PDBj PDBsum | ||||||||
| Ontologija gena | AmiGO / EGO | ||||||||
| |||||||||
 Dihidroorotat dehidrogenaza iz E. coli | |||||||||
| Identifikatori | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Simbol | DHO_dh | ||||||||
| Pfam | PF01180 | ||||||||
| InterPro | IPR001295 | ||||||||
| PROSITE | PDOC00708 | ||||||||
| SCOP | 1dor | ||||||||
| SUPERFAMILY | 1dor | ||||||||
| OPM superfamilija | 59 | ||||||||
| OPM protein | 1uum | ||||||||
| |||||||||
| Ljudska dihidroorotat dehidrogenaza | |
|---|---|
| Identifikatori | |
| Simbol | DHODH |
| Entrez | 1723 |
| HUGO | 2867 |
| OMIM | 126064 |
| PDB | 1D3G |
| RefSeq | NM_001361 |
| UniProt | Q02127 |
| Ostali podaci | |
| EC broj | 1.3.3.1 |
| Lokus | Hromozom 16 q22 |
Dihidroorotat dehidrogenaza (EC 1.3.3.1 1.3.3.1) je enzim koji katalizuje četvrti korak u de novo biosintezi pirimidina.[1][2] Ona pretvara dihidroorotat u orotat:
- (S)-dihidroorotat + O2 orotate + H2O2
Ljudski dihidroorotat dehidrogenaza je sveprisutan FMN flavoprotein. Kod bakterija (gen pyrD), se nalazi na unutarnjoj strani ćelijske membrane. U nekim kvascima, kao kod Saccharomyces cerevisiae (gen URA1), to je citosolni protein, dok se kod ostalih eukariota nalazi u mitohondrijima.[3].
Kliničko značenje
Za anti-upalni lek leflunomid je pokazano da inhibira DHODH. Ljudska DHODH ima dva domena: alfa/beta-barel domen koji sadrži aktivne stranice i alfa-spiralni domen koje formira otvaranje tunela koji vodi do aktivnog mesta[4]. Poznato je da se leflunomid vezuje u ovom tunelu.[5] Leflunomid se koristi za lečenje reumatoidnog artritisa i psorijaze.[6][7]
Mutacije ovog gena su pokazane da uzrokuju Milerov sindrom [8] koji je isto tako poznat kao Genee-Wiedemann sindrom, Wildervanck-Smith sindrom ili post aksijalni akrofacijalni distosis (POADS).
Literatura
- ^ Donald Voet; Judith G. Voet (2005). Biochemistry (3 изд.). Wiley. ISBN 9780471193500.
- ^ Barry Steven Selinsky (2003). „2. Dihydroorotate Dehydrogenase of Escherichia coli”. Membrane Protein Protocols: Expression, Purification, and Characterization (Methods in Molecular Biology (Clifton, N.J.), V.228.). Totowa, NJ: Humana Press. стр. 11—21. ISBN 1-58829-124-3. doi:10.1385/1-59259-400-X:11.
- ^ Lacroute F, Thomas D, Nagy M (1992). „Divergent evolution of pyrimidine biosynthesis between anaerobic and aerobic yeasts”. Proc. Natl. Acad. Sci. U.S.A. 89 (19): 8966—8970. PMID 1409592. doi:10.1073/pnas.89.19.8966.
- ^ Rowland P, Björnberg O, Nielsen FS, Jensen KF, Larsen S (1998). „The crystal structure of Lactococcus lactis dihydroorotate dehydrogenase A complexed with the enzyme reaction product throws light on its enzymatic function”. Protein Sci. 7 (6): 1269—79. PMC 2144028
 . PMID 9655329. doi:10.1002/pro.5560070601. Непознати параметар
. PMID 9655329. doi:10.1002/pro.5560070601. Непознати параметар |month=игнорисан (помоћ) - ^ Liu S, Neidhardt EA, Grossman TH, Ocain T, Clardy J (2000). „Structures of human dihydroorotate dehydrogenase in complex with antiproliferative agents”. Structure. 8 (1): 25—33. PMID 10673429. doi:10.1016/S0969-2126(00)00077-0. Непознати параметар
|month=игнорисан (помоћ) - ^ Thomas L. Lemke; David A. Williams, ур. (2002). Foye's Principles of Medicinal Chemistry (5. изд.). Baltimore: Lippincott Willams & Wilkins. стр. 785—6. ISBN 0781744431.
- ^ Keith Parker; Laurence Brunton; Goodman, Louis Sanford; Lazo, John S.; Gilman, Alfred (2006). „Chapter 52. Immunosuppressants, tolerogens, and immunostimulants; Immunostimulation”. Goodman & Gilman's The Pharmacological Basis of Therapeutics (11. изд.). New York: McGraw-Hill. ISBN 0071422803.
- ^ Ng SB, Buckingham KJ,Lee C, Bigham AW, Tabor HK, Dent KM, Huff CD, Shannon PT, Jabs EW, Nickerson DA, Shendure J, Bamshad MJ (2009). „Exome Sequencing identifies the cause of a mendelian disorder”. Nature Genetics. 42 (1): 30—35. PMID 19915526. Непознати параметар
|month=игнорисан (помоћ)
Vidi isto
Ljudski proteini koji sadrže ove domene
Spoljašnje veze
- dihydroorotate+dehydrogenase на US National Library of Medicine Medical Subject Headings (MeSH)
Ovaj artikal sadrži tekst iz javnog vlasništva Pfam i InterPro IPR001295
 | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |