Geometrijske frustracije
Geometrijske frustracije su u fenomen u fizici kondenzovane materije u kome geometrijske osobine kristalne rešetke ili prisustvo atomskih sila mogu da „zabrane“ spontano opadanje energije, što može dovesti do poremećenog osnovnog stanja, odnosno entropije koja je veća od nule na nula stepini Kelvina.[1][2]
Led
[уреди | уреди извор]Geometrijske frustracije se mogu ilustrovati na primeru leda. Kada su 1936. Giauque i Stout objavili rad „Entropija vode i treći zakon termodinamike“. U tom radu su merili toplotni kapacitet vode na temperaturama od 15 do 273 K i objavili pokazivanja kalorimetra od zamrzavanja vode do njenog isparivanja. Rezultati entropije su bili S1 = 44,28 cal/(K•mol) = 185,3 J/(mol K), a to je rezultat koji se ne poklapa sa teorijskim koji iznosi S2 = 45,10 cal/(K•mol) = 188,7 J/(mol•K), a njihova mećusobna razlika je S0 = 0,82 ± 0,05 cal/(K mol) = 3,4 J/(mol K). Ovu razliku je objasnio Linus Pauling uz pomoć same strukture leda.[3]
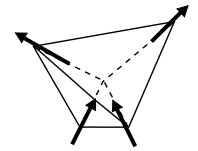
U heksagonalnoj i kockastoj fazi, joni kiseonika formiraju tetraedarnu strukturu kod koje je O-O veza dugačka 276 pm , dok je O-H veza dugačka 96 pm. Svaki jon kiseonika je okružen sa 4 vodonika (crne tačke), a svaki jon vodonika je okružen sa 2 jona kiseonika. Postoje dva ekvivalentna položaja koja vodonik može da ima na O-O vezi daleko i blisko, a mesto sa minimalnom energijom gde se nalazi proton kako bi se zadržala stabilna unutrašnja struktura H2O molekula nije na polovini O-O veze. Pauling je zato dao pravilo za frustracije položaja protona za održavanje osnovne konfiguracije: za svaki jon kiseonika dva susedna protona moraju da ostanu u dalekim, a dva u bliskim položaju.
Na osnovu ovoga on je računao entropiju. Uzeo je jedan mol leda koji se sastoji od N O-2 i 2N protona. Svaka O-O veza ima dve pozicije za proton, što znači da ima 22 N mogućih konfiguracija. Međutim od 16 mogućih konfiguracija za svaki kiseonik samo 6 su energetski povoljne i zadržavaju stabilnost H2O molekula, pa je broj mogućih stanja Ω < 22N(6/16)N. Entropija na nula Kelvina S0= kBln(Ω) = NkBln(3/2) = 0,81 cal/(K mol) = 3,4 J/(mol K).
Reference
[уреди | уреди извор]- ^ J.F. Sadoc and R. Mosseri (2007). Geometrical Frustration. Cambridge University Press.
- ^ Sadoc, JF, ур. (1990). Geometry in condensed matter physics. Singapore: World Scientific.
- ^ Pauling, Linus (1935). „The Structure and Entropy of Ice and of Other Crystals with Some Randomness of Atomic Arrangement”. J. Am. Chem. Soc. 57 (12): 2680—2684. doi:10.1021/ja01315a102.
Literatura
[уреди | уреди извор]- Sadoc, JF, ур. (1990). Geometry in condensed matter physics. Singapore: World Scientific.
- J.F. Sadoc and R. Mosseri (2007). Geometrical Frustration. Cambridge University Press.
