Натријум декаванадат
| |

| |
| Идентификација | |
|---|---|
| Својства | |
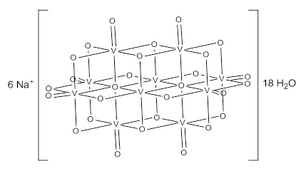
| Na6[V10O28] | |
| Моларна маса | 1419,6 g |
| Агрегатно стање | наранџаста чврста материја |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Натријум декаванадат се односи на било којег члана фамилије неорганских једињења са формулом На6[V10О28](Х2О)н. Та једињења су натријумске соли наранџасто обојеног декаванадатног ањона [V10О28]6−.[1] Бројне друге декаванадатне соли су изоловане и изучаване од 1956, када је прва со окарактерисана.[2]
Припрема[уреди | уреди извор]
Декаванадат се припрема закишељавањем воденог раствора орто-ванадата:[1]
- 10 На3[ВО4] + 24 ХОАц → На6[V10О28] + 12 Х2О + 24 НаОАц
Формирања декаванадата се оптимално одвија у пХ опсегу од 4–7. Типични нуспроизводи обухватају метаванадатне, [ВО3]−, и хексаванадатне, [V6О16]2−, јоне.[1]
Структура[уреди | уреди извор]
Декаванадатни јон се састоји од 10 стопљених ВО6 октаедара и има D2х симетрију.[3][4][5] Структура На6[V10О28]·18Х2О је кристалографски потврђена.[6]

Декаванадатни ањони се садрже три сета еквивалентних V атома.[3] Тиме су обухваћена два централна ВО6 октаедра (Vц) и четири периферне тетрагонално пирамидалне ВО5 групе (Vа анд Vб). Постоји седам јединствених група атома кисеоника (означених са А до Г). Две од њих (А) премоштавају шест V центара, четири (Б) премоштавају три V центра, четрнаест група (C, D и Е) формирају ивице између парова V центра, и осам (Ф и Г) су периферне.
Оксидационо стање ванадијума у декаванадату је +5.
Кисело-базна својства[уреди | уреди извор]
Водени раствори ванадат(V) једињења подлежу разним реакцијама само-кондензације.[7] У зависности од пХ вредности, главни ванадатни јони и раствору су ВО2(Х2О)42+, ВО43−, V2О73−, V3О93−, V4О124−, и V10О266−. Ањони се често реверзибилно протонишу.[5] Декаванадат формира следеће равнотеже:[2][7]
- Х3V10О283− ⇌ Х2V10О284− + Х+
- Х2V10О284− ⇌ ХВ10О285− + Х+
- ХВ10О285−(аq) ⇌ V10О286− + Х+
Структура разних протонационих стања декаванадатног јона је изучавана путем 51V НМР спектроскопије.[5][7] Свака врста даје три сигнала; са благо варирајућим хемијским помациима око −425, −506, анд −523 ппм релативно на ванадијум окситрихлорид; што сугерише да постоји брза протонска размена која доводи до једнако симетричних врста.[8] За три протонациона стања декаванадата је показано да се јављају на премоштавајућим кисеоничним центрима, који су означени са Б и C на слици.[8]
Декаванадат је најстабилнији у пХ 4–7 региону.[1][4][7] Раствори ванадата постају светло наранџасти на пХ 6.5, услед присуства декаванадата. Други ванадати су безбојни. Испод пХ 2.0, смеђи V2О5 преципитира као хидрат.[3][7]
- V10О286− + 6Х+ + 12Х2 ⇌ 5В2О5
Сродни декаванадати[уреди | уреди извор]
Многе декаванадатне соли су окарактерисане. НХ4+, Ца2+, Ба2+, Ср2+, и декаванадатне соли групе I се припремају кисело-базном реакцијом између V2О5 и оксида, хидроксида, карбоната, или бикарбоната жељеног позитивног јона.[1]
- 6 НХ3 + 5 V2О5 + 3 Х2О ⇌ (НХ4)6[V10О28]
Други декаванадати:[9]
- (НХ4)6[V10О28]·6Х2О[2]
- К6[V10О28]·9Х2О[2]
- К6[V10О28]·10Х2О[1][2][3]
- Ца3[V10О28]·16Х2О[2][3]
- К2Мг2[V10О28]·16Х2О[2][3]
- К2Зн2[V10О28]·16Х2О[1][2][3]
- Цс2Мг2[V10О28]·16Х2О[3]
- Цс4На2[V10О28]·10Х2О[10]
- К4На2[V10О28]·16Х2О[11]
- Ср3[V10О28]·22Х2О[10]
- Ба3[V10О28]·19Х2О[10]
- [(C6Х5)4П]Х3V10О28·4ЦХ3ЦН[8]
- Аг6[V10О28]·4Х2О[12]
Референце[уреди | уреди извор]
- ^ а б в г д ђ е Јохнсон, Г.; Мурманн, Р. К. (2007). „Содиум анд Аммониум Децаванадатес”. Инорганиц Сyнтхесес. 19: 140—145. дои:10.1002/9780470132500.цх32.
- ^ а б в г д ђ е ж Россотти, Ф. Ј.; Россотти, Х. (1956). „Еqуилибриум Студиес оф Полyанионс”. Ацта Цхемица Сцандинавица. 10: 957—984. дои:10.3891/ацта.цхем.сцанд.10-0957.
- ^ а б в г д ђ е ж Еванс Јр., Х. Т. (1966). „Тхе молецулар струцтуре оф тхе исополy цомплеx ион, децаванадате”. Инорг. Цхем. 5: 967—977. дои:10.1021/иц50040а004.
- ^ а б Кустин, К.; Пессоа, Ј. C.; Цранс, D. C. (2007). Вандадиум: Тхе Версатиле Метал. Wасхингтон, D. C.: Америцан Цхемицал Социетy. ИСБН 978-0-8412-7446-4.
- ^ а б в Рехдер, D. (2008). Биоинорганиц Ванадиум Цхемистрy. Wилеy & Сонс. стр. 13–51. ИСБН 978-0-470-06509-9.
- ^ Дуриф, П.А.; Авербуцх-поуцхот, M.Т. (1980). „Струцтуре д’ун Дéцаванадате д’Хеxасодиум Хyдратé”. Ацта Црyсталлогр. Б. 36: 680—682. дои:10.1107/С0567740880004116.
- ^ а б в г д Трацеy, А.С.; Цранс, D.C. (1998). Ванадиум Цомпоундс. Wасхингтон D.C.: Америцан Цхемицал Социетy. ИСБН 0-8412-3589-9.
- ^ а б в Даy, V. W.; Клемперер, W. Г.; Малтбие, D. Ј. (1987). „Wхере Аре тхе Протонс ин Х3V10О283−?”. Ам. Цхем. Соц. 109: 2991—3002. дои:10.1021/ја00244а022.
- ^ Аурелиано, Мануел; Цранс, Деббие C. (2009). "Децаванадате анд оxованадатес: Оxометалатес wитх манy биологицал ацтивитиес". Јоурнал Инорганиц Биоцхемистрy 103: 536–546. . дои:10.1016/ј.јиноргбио.2008.11010. Недостаје или је празан параметар
|титле=(помоћ). - ^ а б в Даметто, А.C.; де Араују, А.С.; де Соуза Цорреа, Р.; Гуилхерме, L.Р.; Массабни, А.C. (2010). „Сyнтхесис, инфраред спецтросцопy анд црyстал струцтуре детерминатион оф а неw децаванадате”. Ј Цхем Црyсталлогр. 40: 897—901. дои:10.1007/с10870-010-9759-x.
- ^ Матиас, П.M.; Пессоа, Ј.C.; Дуарте, M.Т.; Мадериа, C. (2000). „Тетрапотассиум дисодиум децаванадате(V) децахyдрате”. Ацта Црyсталлогр. C. 57: е75—е76. дои:10.1107/С0108270100001530.
- ^ Есцобар, M.Е.; Баран, Е.Ј. (1981). „Дие Сцхwингунгсспектрен еинигер кристаллинер Декаванадате”. Монатсхефте фур Цхемие. 112: 43—49.
