Natrijum dekavanadat
| |

| |
| Identifikacija | |
|---|---|
| Svojstva | |
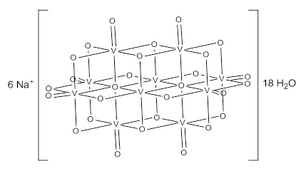
| Na6[V10O28] | |
| Molarna masa | 1419,6 g |
| Agregatno stanje | narandžasta čvrsta materija |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Natrijum dekavanadat se odnosi na bilo kojeg člana familije neorganskih jedinjenja sa formulom Na6[V10O28](H2O)n. Ta jedinjenja su natrijumske soli narandžasto obojenog dekavanadatnog anjona [V10O28]6−.[1] Brojne druge dekavanadatne soli su izolovane i izučavane od 1956, kadа je prva so okarakterisana.[2]
Priprema[уреди | уреди извор]
Dekavanadat se priprema zakišeljavanjem vodenog rastvora orto-vanadata:[1]
- 10 Na3[VO4] + 24 HOAc → Na6[V10O28] + 12 H2O + 24 NaOAc
Formiranja dekavanadata se optimalno odvija u pH opsegu od 4–7. Tipični nusproizvodi obuhvataju metavanadatne, [VO3]−, i heksavanadatne, [V6O16]2−, jone.[1]
Struktura[уреди | уреди извор]
Dekavanadatni jon se sastoji od 10 stopljenih VO6 oktaedara i ima D2h simetriju.[3][4][5] Struktura Na6[V10O28]·18H2O je kristalografski potvrđena.[6]

Dekavanadatni anjoni se sadrže tri seta ekvivalentnih V atoma.[3] Time su obuhvaćena dva centralna VO6 oktaedra (Vc) i četiri periferne tetragonalno piramidalne VO5 grupe (Va and Vb). Postoji sedam jedinstvenih grupa atoma kiseonika (označenih sa A do G). Dve od njih (A) premoštavaju šest V centara, četiri (B) premoštavaju tri V centra, četrnaest grupa (C, D i E) formiraju ivice između parova V centra, i osam (F i G) su periferne.
Oksidaciono stanje vanadijuma u dekavanadatu je +5.
Kiselo-bazna svojstva[уреди | уреди извор]
Vodeni rastvori vanadat(V) jedinjenja podležu raznim reakcijama samo-kondenzacije.[7] U zavisnosti od pH vrednosti, glavni vanadatni joni i rastvoru su VO2(H2O)42+, VO43−, V2O73−, V3O93−, V4O124−, i V10O266−. Anjoni se često reverzibilno protonišu.[5] Dekavanadat formira sledeće ravnoteže:[2][7]
- H3V10O283− ⇌ H2V10O284− + H+
- H2V10O284− ⇌ HV10O285− + H+
- HV10O285−(aq) ⇌ V10O286− + H+
Struktura raznih protonacionih stanja dekavanadatnog jona je izučavana putem 51V NMR spektroskopije.[5][7] Svaka vrsta daje tri signala; sa blago varirajućim hemijskim pomaciima oko −425, −506, and −523 ppm relativno na vanadijum oksitrihlorid; što sugeriše da postoji brza protonska razmena koja dovodi do jednako simetričnih vrsta.[8] Za tri protonaciona stanja dekavanadata je pokazano da se javljaju na premoštavajućim kiseoničnim centrima, koji su označeni sa B i C na slici.[8]
Dekavanadat je najstabilniji u pH 4–7 regionu.[1][4][7] Rastvori vanadata postaju svetlo narandžasti na pH 6.5, usled prisustva dekavanadata. Drugi vanadati su bezbojni. Ispod pH 2.0, smeđi V2O5 precipitira kao hidrat.[3][7]
- V10O286− + 6H+ + 12H2 ⇌ 5V2O5
Srodni dekavanadati[уреди | уреди извор]
Mnoge dekavanadatne soli su okarakterisane. NH4+, Ca2+, Ba2+, Sr2+, i dekavanadatne soli grupe I se pripremaju kiselo-baznom reakcijom između V2O5 i oksida, hidroksida, karbonata, ili bikarbonata željenog pozitivnog jona.[1]
- 6 NH3 + 5 V2O5 + 3 H2O ⇌ (NH4)6[V10O28]
Drugi dekavanadati:[9]
- (NH4)6[V10O28]·6H2O[2]
- K6[V10O28]·9H2O[2]
- K6[V10O28]·10H2O[1][2][3]
- Ca3[V10O28]·16H2O[2][3]
- K2Mg2[V10O28]·16H2O[2][3]
- K2Zn2[V10O28]·16H2O[1][2][3]
- Cs2Mg2[V10O28]·16H2O[3]
- Cs4Na2[V10O28]·10H2O[10]
- K4Na2[V10O28]·16H2O[11]
- Sr3[V10O28]·22H2O[10]
- Ba3[V10O28]·19H2O[10]
- [(C6H5)4P]H3V10O28·4CH3CN[8]
- Ag6[V10O28]·4H2O[12]
Reference[уреди | уреди извор]
- ^ а б в г д ђ е Johnson, G.; Murmann, R. K. (2007). „Sodium and Ammonium Decavanadates”. Inorganic Syntheses. 19: 140—145. doi:10.1002/9780470132500.ch32.
- ^ а б в г д ђ е ж Rossotti, F. J.; Rossotti, H. (1956). „Equilibrium Studies of Polyanions”. Acta Chemica Scandinavica. 10: 957—984. doi:10.3891/acta.chem.scand.10-0957.
- ^ а б в г д ђ е ж Evans Jr., H. T. (1966). „The molecular structure of the isopoly complex ion, decavanadate”. Inorg. Chem. 5: 967—977. doi:10.1021/ic50040a004.
- ^ а б Kustin, K.; Pessoa, J. C.; Crans, D. C. (2007). Vandadium: The Versatile Metal. Washington, D. C.: American Chemical Society. ISBN 978-0-8412-7446-4.
- ^ а б в Rehder, D. (2008). Bioinorganic Vanadium Chemistry. Wiley & Sons. стр. 13–51. ISBN 978-0-470-06509-9.
- ^ Durif, P.A.; Averbuch-pouchot, M.T. (1980). „Structure d’un Décavanadate d’Hexasodium Hydraté”. Acta Crystallogr. B. 36: 680—682. doi:10.1107/S0567740880004116.
- ^ а б в г д Tracey, A.S.; Crans, D.C. (1998). Vanadium Compounds. Washington D.C.: American Chemical Society. ISBN 0-8412-3589-9.
- ^ а б в Day, V. W.; Klemperer, W. G.; Maltbie, D. J. (1987). „Where Are the Protons in H3V10O283−?”. Am. Chem. Soc. 109: 2991—3002. doi:10.1021/ja00244a022.
- ^ Aureliano, Manuel; Crans, Debbie C. (2009). "Decavanadate and oxovanadates: Oxometalates with many biological activities". Journal Inorganic Biochemistry 103: 536–546. . doi:10.1016/j.jinorgbio.2008.11010. Недостаје или је празан параметар
|title=(помоћ). - ^ а б в Dametto, A.C.; de Arauju, A.S.; de Souza Correa, R.; Guilherme, L.R.; Massabni, A.C. (2010). „Synthesis, infrared spectroscopy and crystal structure determination of a new decavanadate”. J Chem Crystallogr. 40: 897—901. doi:10.1007/s10870-010-9759-x.
- ^ Matias, P.M.; Pessoa, J.C.; Duarte, M.T.; Maderia, C. (2000). „Tetrapotassium disodium decavanadate(V) decahydrate”. Acta Crystallogr. C. 57: e75—e76. doi:10.1107/S0108270100001530.
- ^ Escobar, M.E.; Baran, E.J. (1981). „Die Schwingungsspektren einiger kristalliner Dekavanadate”. Monatshefte fur Chemie. 112: 43—49.
