Хесов закон топлоте
Хесов закон константног сабирања топлоте, такође познат једноставно као Хесов закон, је однос у физичкој хемији назван по Жермену Хесу, руском хемичару и лекару рођеном у Швајцарској који га је објавио 1840. Закон каже да се укупна енталпија промена током комплетног тока хемијске реакције је независан од редоследа предузетих корака. [1][2]
Хесов закон се сада схвата као израз чињенице да је енталпија хемијског процеса независна од путање од почетног до коначног стања (тј. енталпија је функција стања). Према првом закону термодинамике, промена енталпије у систему услед реакције при константном притиску једнака је апсорбованој топлоти (или негативу ослобођене топлоте), што се може одредити калориметријом за многе реакције. Вредности се обично наводе за реакције са истим почетним и крајњим температурама и притисцима (док је дозвољено да услови варирају у току реакција). Хесов закон се може користити за одређивање укупне енергије потребне за хемијску реакцију која се може поделити на синтетичке кораке које је појединачно лакше окарактерисати. Ово омогућава компилацију стандардних енталпија формирања, које се могу користити за предвиђање промене енталпије у комплексним синтезама.
Теорија[уреди | уреди извор]
Хесов закон каже да је промена енталпије у хемијској реакцији иста без обзира да ли се реакција одвија у једном кораку или у неколико корака, под условом да су почетно и коначно стање реактаната и производа исти. Енталпија је екстензивно својство, што значи да је њена вредност пропорционална величини система. [3] Због тога је промена енталпије пропорционална броју молова који учествују у датој реакцији.
Другим речима, ако се хемијска промена одвија на неколико различитих путева, укупна промена енталпије је иста, без обзира на пут којим се хемијска промена дешава (под условом да су почетни и коначни услови исти). Ако ово није тачно, онда би се могао прекршити први закон термодинамике.
Хесов закон дозвољава да се промена енталпије (ΔХ) за реакцију израчуна чак и када се не може директно измерити. Ово се постиже извођењем основних алгебарских операција заснованих на хемијским једначинама реакција коришћењем претходно одређених вредности за енталпије формирања.
Комбинација хемијских једначина доводи до нето или укупне једначине. Ако су промене енталпије познате за све једначине у низу, њихов збир ће бити промена енталпије за нето једначину. Ако је нето промена енталпије негативна (), реакција је егзотермна и већа је вероватноћа да ће бити спонтана; позитивне ΔХ вредности одговарају ендотермним реакцијама. (Ентропија такође игра важну улогу у одређивању спонтаности, пошто су неке реакције са позитивном променом енталпије ипак спонтане због повећања ентропије у реакционом систему.)
Употреба енталпије формирања[уреди | уреди извор]
Хесов закон каже да су промене енталпије адитивне. Дакле, вредност од за једну реакцију може се израчунати из табеларне енталпије формирања производа и реактаната на следећи начин:
Овде је први збир за све производе п, а други за све реактанте р, је стехиометријски коефицијент производа је стехиометријски коефицијент реактанта р, је енталпија формирања производа п, је енталпија формирања реактанта р, а горњи индекс о означава стандардне вредности стања. Ово се може сматрати збиром две (стварне или фиктивне) реакције:
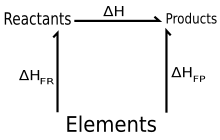
- Реактанти → Елементи (у њиховим стандардним стањима)
и Елементи → Производи
Примери[уреди | уреди извор]
- Даје:
- Cграпхите + О2 → ЦО2(г) ( ΔХ = −393.5 кЈ/мол) (дирецт степ)
- Cграпхите + 1/2 О2 → ЦО(г) (ΔХ = −110.5 кЈ/мол)
- ЦО(г) +1/2 О2 → ЦО2(г) (ΔХ = −283.0 кЈ/мол)
Реакција (а) је збир реакција (б) и (ц), за које је укупно ΔХ = −393.5 кЈ/мол, што је једнако ΔХ у (а).
- Даје:
- Б2О3(с) + 3Х2О(г) → 3О2(г) + Б2Х6(г) (ΔХ = 2035 кЈ/мол)
- Х2О(л) → Х2О(г) (ΔХ = 44 кЈ/мол)
- Х2(г) + 1/2 О2(г) → Х2О(л) (ΔХ = −286 кЈ/мол)
- 2Б(с) + 3Х2(г) → Б2Х6(г) (ΔХ = 36 кЈ/мол)
- 2Б(с) + 3/2 О2(г) → Б2О3(с)
- Б2Х6(г) + 3О2(г) → Б2О3(с) + 3Х2О(г) (ΔХ = 2035 × (−1) = −2035 кЈ/мол)
- 3Х2О(г) → 3Х2О(л) (ΔХ = 44 × (−3) = −132 кЈ/мол)
- 3Х2О(л) → 3Х2(г) + (3/2) О2(г) (ΔХ = −286 × (−3) = 858 кЈ/мол)
- 2Б(с) + 3Х2(г) → Б2Х6(г) (ΔХ = 36 кЈ/мол)
- 2Б(с) + 3/2 О2(г) → Б2О3(с) (ΔХ = −1273 кЈ/мол)
Проширење на слободну енергију и ентропију[уреди | уреди извор]
Концепти Хесовог закона могу се проширити и укључити промене ентропије и Гибсове слободне енергије, пошто су то такође функције стања . Бордвелов термодинамички циклус је пример таквог проширења које користи предности лако мерљивих равнотежа и редокс потенцијала за одређивање експериментално неприступачних Гибсових вредности слободне енергије. Комбиновање ΔГо вредности из Бордвелових термодинамичких циклуса и ΔХо вредности пронађених са Хесовим законом може бити од помоћи у одређивању вредности ентропије које нису директно измерене и стога их је потребно израчунати кроз алтернативне путеве.
За бесплатну енергију:
Што се тиче ентропије, ситуација је мало другачија. Пошто се ентропија може мерити као апсолутна вредност, а не у односу на оне елемената у њиховим референтним стањима (као код ΔХо и ΔГо), нема потребе да се користи ентропија формирања; једноставно се користе апсолутне ентропије за производе и реактанте:
Апликације[уреди | уреди извор]
Хесов закон је користан за одређивање енталпија за следеће: [1]
- Топлоте формирања нестабилних интермедијера као што су ЦО(г) анд НО(г).
- Промене топлоте у фазним прелазима и алотропним прелазима.
- Решетке енергије јонских супстанци конструисањем Борн–Хаберових циклуса ако је познат афинитет електрона за формирање ањона, или
- Електронски афинитети коришћењем Борн–Хаберовог циклуса са теоретском енергијом решетке.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б Маннам Крисхнамуртхy; Субба Рао Наиду (2012). „7”. Ур.: Локесwара Гупта. Цхемистрy фор ИСЕЕТ - Волуме 1, Парт А (2012 изд.). Хyдерабад, Индиа: Варситy Едуцатион Манагемент Лимитед. стр. 244.
- ^ „Хесс' Лаw - Цонсерватион оф Енергy”. Университy оф Wатерлоо. Архивирано из оригинала 9. 1. 2015. г. Приступљено 12. 1. 2014.
- ^ Енгел, Тхомас; Реид, Пхилип (2006). Пхyсицал Цхемистрy. Пеарсон / Бењамин Цуммингс. стр. 6. ИСБН 0-8053-3842-X. „А вариабле ... пропортионал то тхе сизе оф тхе сyстем ис реферред то ас ан еxтенсиве вариабле.”
- Цхакрабартy, D.К. (2001). Ан Интродуцтион то Пхyсицал Цхемистрy. Мумбаи: Алпха Сциенце. стр. 34—37. ИСБН 1-84265-059-9.
Литература[уреди | уреди извор]
- Леицестер, Хенрy M. (1951). „Гермаин Хенри Хесс анд тхе Фоундатионс оф Тхермоцхемистрy”. Тхе Јоурнал оф Цхемицал Едуцатион. 28 (11): 581–583. Бибцоде:1951ЈЦхЕд..28..581Л. дои:10.1021/ед028п581.
Спољашње везе[уреди | уреди извор]
- Хесс' папер (1840) он wхицх хис лаw ис басед (на сајту ЦхемТеам)
- а Хесс’ Лаw еxперимент Архивирано на сајту Wayback Machine (3. март 2016)











