Хемијске једначине
Хемијске једначине приказују у стехиометријским односима реакције различитих хемијских елемената и једињења, тј. хемијски процес.[а] На левој страни једначине су хемијски елементи које улазе у процес, а на десној једињења која хемијским процесом настају. Уместо знака једнакости пише се стрелица (→) која означава смер у коме се промена догађа.[1][2]
Пример оксидације натријума:
- 4Na + O2 → 2Na2O
Стехиометријски коефицијенти (бројеви испред хемијских формула) резултат су закона о одржању масе и закона о одржању наелектрисања. Закон о одржању масе диктира да се количина сваког елемента у хемијској реакцији не мења. Дакле, свака страна хемијске једначине мора представљати исту количину било којег одређеног елемента. Исто тако, наелектрисање се чува у хемијској реакцији. Према томе, исто наелектрисање мора бити присутно на обе стране уравнотежене једначине.
Формирање хемијске реакције[уреди | уреди извор]
Хемијска једначина се састоји од хемијских формула реактаната (почетне супстанце) и хемијске формуле производа (супстанци насталих у хемијској реакцији). Ова два сета су раздвојена симболом стрелице (→, обично се чита као „даје“), а хемијска формула сваке појединачне супстанце је одвојена од осталих знаком плус.
Као пример, једначина за реакцију хлороводоничне киселине са натријумом може се означити са:
- 2 HCl + 2 Na → 2 NaCl + H
2
Ова једначина би се читала као „два HCl плус два Na даје два NaCl и два H”. Али, за једначине које укључују сложене хемикалије, уместо читања слова и његовог индекса, хемијске формуле се читају кориштењем IUPAC номенклатуре. Користећи IUPAC номенклатуру, ова једначина би се читала као „хлороводонична киселина плус натријум даје натријум хлорид и гас водоник”.
Ова једначина показује да натријум и HCl реагују и формирају NaCl и H2. Такође указује да су два молекула натријума потребна за свака два молекула хлороводоничне киселине и реакција ће формирати два молекула натријум хлорида и један двоатомни молекул гасовитог водоника за свака два молекула хлороводонична киселина и два молекула натријума који реагују. Стехиометријски коефицијенти (бројеви испред хемијских формула) произилазе из закона одржања масе и закона одржања наелектрисања (погледајте одељак „Уравнотежавање хемијских једначина“ испод за више информација).
Уобичајени симболи[уреди | уреди извор]

Симболи се користе за разликовање различитих типова реакција. Да се означи тип реакције:[1]
- „” симбол се користи за означавање стехиометријске релације.
- „” симбол се користи за означавање нето реакције унапред.
- „” симбол се користи за означавање реакције у оба смера.[3]
- „” симбол се користи за означавање равнотеже.[4]
Физичко стање хемикалија се такође врло често наводи у заградама после хемијског симбола, посебно за јонске реакције. Када се наводи физичко стање, (s) означава чврсту материју, (l) означава течност, (g) означава гас и (aq) означава водени раствор.
Ако реакција захтева енергију, то је назначено изнад стрелице. Велико грчко слово делта ([5]) се ставља на реакциону стрелицу како би се показало да се реакција додаје енергија у облику топлоте. Израз [6] се користи као симбол за додавање енергије у облику светлости. Други симболи се користе за друге специфичне врсте енергије или зрачења.
Балансирање хемијских једначина[уреди | уреди извор]
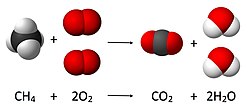
4 + 2 O
2 → CO
2 + 2 H
2O, коефицијент 2 мора се ставити испред гаса кисеоника на страни реактаната и испред воде на страни производа како се, према закону одржања масе, количина сваког елемента не би променила током реакције

Ова хемијска једначина се балансира тако што се прво множи H3PO4 са четири да би се ускладио број атома P, а затим множењем H2O са шест да би се ускладио број атома H и O.
Закон одржања масе налаже да се количина сваког елемента не мења у хемијској реакцији. Свака страна хемијске једначине мора представљати исту количину било ког датог елемента. Исто тако, наелектрисање се очувава у хемијској реакцији. Стога, исти набој мора бити присутан на обе стране уравнотежене једначине.
Једна хемијска једначина се балансира променом скаларног броја за сваку хемијску формулу. Једноставне хемијске једначине се могу избалансирати инспекцијом, односно покушајима и грешкама. Друга техника подразумева решавање система линеарних једначина.
Балансиране једначине се често пишу са најмањим целобројним коефицијентима. Ако испред хемијске формуле нема коефицијента, коефицијент је 1.
Метода инспекције се може описати као стављање коефицијента 1 испред најсложеније хемијске формуле и стављање осталих коефицијената испред свега осталог тако да обе стране стрелице имају исти број сваког атома. Ако постоји било који фракциони коефицијент, множи се сваки коефицијент са најмањим бројем који је потребан да би се они учинили целим, обично имениоцем разломачног коефицијента за реакцију са једним фракционим коефицијентом.
Као пример, који се види на горњој слици, сагоревање метана би се избалансирало стављањем коефицијента 1 испред CH4:
- 1 CH4 + O2 → CO2 + H2O
Пошто се на свакој страни стрелице налази по један угљеник, први атом (угљеник) је уравнотежен.
Гледајући следећи атом (водоник), десна страна има два атома, док лева има четири. Да би се уравнотежили водоници, 2 иде испред H2O, што даје:
- 1 CH4 + O2 → CO2 + 2 H2O
Преглед последњег атома који треба да се балансира (кисеоника) показује да десна страна има четири атома, док лева има два. То се може избалансирати стављањем 2 испред O2, дајући уравнотежену једначину:
- CH4 + 2 O2 → CO2 + 2 H2O
Ова једначина нема коефицијенте испред CH4 и CO2, пошто је коефицијент 1 испуштен.
Треба имати на уму да у неким околностима није исправно писати уравнотежену реакцију са свим целобројним коефицијентима. На пример, реакција која одговара стандардној енталпији формирања мора бити написана тако да се формира један мол једног производа. Ово ће често захтевати да неки коефицијенти реактаната буду фракциони, као што је случај са формирањем литијум флуорида:
- Li(s) + 1⁄2 F2(g) → LiF(s)
Матрична метода[уреди | уреди извор]
Генерално, свака хемијска једначина која укључује J различитих молекула може се написати као:
где је Rj симбол за j-ти молекул, а νj је стехиометријски коефицијент за j-ти молекул, позитиван за производе, негативан за реактанте (или обрнуто). Правилно избалансирана хемијска једначина ће се тада придржавати:
где је матрица композиције aij број атома елемента i у молекулу j. За сваки вектор који, када њиме оперише композициона матрица, добије се нулти вектор, и каже се да је члан језгра или нулти простор оператора. Било који члан νj нултог простора aij служиће за балансирање хемијске једначине која укључује скуп J молекула који чине систем. „Преферирани“ стехиометријски вектор је онај за који се сви његови елементи могу конвертовати у целе бројеве без заједничких делилаца множењем са одговарајућом константом.
Генерално, матрица композиције је дегенерисана: то јест, неће сви њени редови бити линеарно независни. Другим речима, ранг (JR) матрице композиције је генерално мањи од њеног броја колона (J). По теореми о нултом рангу, нулти простор aij ће имати J-JR димензије и овај број се зове нулитет (JN) од aij. Проблем балансирања хемијске једначине тада постаје проблем одређивања JN-димензионалног нултог простора композиционе матрице. Важно је напоменути да ће само за JN=1 постојати јединствено решење. За JN>1 постојаће бесконачан број решења за проблем балансирања, али само JN њих ће бити независно: Ако се могу пронаћи JN независна решења за проблем балансирања, онда ће било које друго решење бити линеарна комбинација ових решења. Ако је JN=0, неће бити решења за проблем балансирања.
Развијене су технике[7][8] за брзо израчунавање скупа JN независних решења за проблем балансирања и супериорне су од инспекцијске и алгебарске методе по томе што су детерминативне и дају сва решења за проблем балансирања.
Јонске једначине[уреди | уреди извор]
Јонска једначина је хемијска једначина у којој су електролити записани као дисоцирани јони. Јонске једначине се користе за реакције једноструког и двоструког померања које се јављају у воденим растворима.
На пример, у следећој реакцији таложења:
пуна јонска једначина је:
или, са укљученим свим физичким стањима:
У овој реакцији, јони Ca2+ и NO3− остају у раствору и нису део реакције. То јест, ови јони су идентични на страни реактаната и на страни производа хемијске једначине. Пошто такви јони не учествују у реакцији, они се називају посматрачким јонима. Нето јонска једначина је пуна јонска једначина из које су уклоњени посматрачки јони.[9] Нето јонска једначина текућих реакција је:
или, у редукованом избалансираном облику,
У реакцији неутрализације или кисело/базне реакције, нето јонска једначина ће обично бити:
- H+(aq) + OH−(aq) → H2O(l)
Постоји неколико реакција киселина/база које производе талог поред молекула воде приказаног изнад. Пример је реакција баријум хидроксида са фосфорном киселином, која не производи само воду већ и нерастворљиву со баријум фосфат. У овој реакцији нема посматрачког јона, тако да је нето јонска једначина иста као пуна јонска једначина.
Реакције двоструког померања које карактеришу карбонат који реагује са киселином имају нето јонску једначину:
Ако је сваки јон „посматрачки јон” онда не долази до реакције, а нето јонска једначина је нула.
Генерално, ако је zj умножак елементарног наелектрисања на j-том молекулу, неутралност наелектрисања се може написати као:
где су νj стехиометријски коефицијенти описани горе. Коефицијент zj се може инкорпорирати[7][8] као додатни ред у матрицу aij описану горе, и правилно избалансирана јонска једначина ће тада такође имати:
Напомене[уреди | уреди извор]
- ^ стехиометрија, хемијско мерење: учење о пропорцији
Референце[уреди | уреди извор]
- ^ а б IUPAC. Compendium of Chemical Terminology, 2nd ed. ISBN 0-9678550-9-8.
- ^ Crosland, M.P. (1959). „The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black”. Annals of Science. 15 (2): 75—90.
- ^ The notation was proposed in 1884 by the Dutch chemist Jacobus Henricus van 't Hoff. See: van 't Hoff, J.H. (1884). Études de Dynamique Chemique [Studies of chemical dynamics] (на језику: француски). Amsterdam, Netherlands: Frederik Muller & Co. стр. 4—5. Van 't Hoff called reactions that didn't proceed to completion "limited reactions". From pp. 4–5: "Or M. Pfaundler a relié ces deux phénomênes … s'accomplit en même temps dans deux sens opposés." (Now Mr. Pfaundler has joined these two phenomena in a single concept by considering the observed limit as the result of two opposing reactions, driving the one in the example cited to the formation of sea salt [i.e., NaCl] and nitric acid, [and] the other to hydrochloric acid and sodium nitrate. This consideration, which experiment validates, justifies the expression "chemical equilibrium", which is used to characterize the final state of limited reactions. I would propose to translate this expression by the following symbol:
- HCl + NO3 Na NO3 H + Cl Na.
- ^ The notation was suggested by Hugh Marshall in 1902. See: Marshall, Hugh (1902). „Suggested Modifications of the Sign of Equality for Use in Chemical Notation”. Proceedings of the Royal Society of Edinburgh. 24: 85—87. doi:10.1017/S0370164600007720.
- ^ The symbol is more properly denoted as a simple triangle (△), which was originally the alchemical symbol for fire.
- ^ This symbol comes from the Planck equation for the energy of a photon, . It is sometimes mistakenly written with a 'v' ("vee") instead of the Greek letter '' ("nu")
- ^ а б Thorne, Lawrence R. (2010). „An Innovative Approach to Balancing Chemical-Reaction Equations: A Simplified Matrix-Inversion Technique for Determining the Matrix Null Space”. Chem. Educator. 15: 304—308. arXiv:1110.4321
 .
.
- ^ а б Holmes, Dylan (2015). „The null space's insight into chemical balance”. Dylan Holmes. Приступљено 10. 10. 2017.
- ^ James E. Brady; Frederick Senese; Neil D. Jespersen (14. 12. 2007). Chemistry: matter and its changes. John Wiley & Sons. ISBN 9780470120941. LCCN 2007033355.



















