α,β-Nezasićeno karbonilno jedinjenje
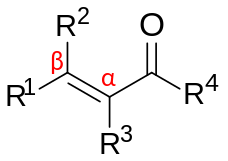
α,β-Nezasićena karbonilna jedinjenja su organska jedinjenja opšte strukture (O=CR)−Cα=Cβ-R.[1][2] Takva jedinjenja uključuju enone i enale, ali i karboksilne kiseline i odgovarajuće estre i amide. U ovim jedinjenjima, karbonilna grupa je konjugovana sa alkenom (otuda pridev nezasićen). Za razliku od slučaja karbonila bez bočne alkenske grupe, α,β-nezasićena karbonilna jedinjenja su podložna napadu nukleofila na β-ugljeniku. Ovaj obrazac reaktivnosti naziva se vinilognim. Primeri nezasićenih karbonila su akrolein (propenal), mezitil oksid, akrilna kiselina i maleinska kiselina. Nezasićeni karbonili se mogu pripremiti u laboratoriji u aldolnoj reakciji i u Perkinovoj reakciji.
Klasifikacije
[уреди | уреди извор]α,β-Nezasićena karbonilna jedinjenja mogu se podklasisati prema prirodi karbonilnih i alkenskih grupa.
- Osnovni α,β-nezasićeni karbonili
-
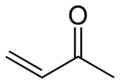
Metil vinil keton, najjednostavniji α,β-nezasićeni keton
-
Akrolein, najjednostavniji α,β-nezasićeni aldehid
-
Metil akrilat, α,β-nezasićeni estar
-
Akrilamid, prekursor poliakrilamida
-
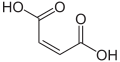
Maleinska kiselina, α,β-nezasićeni dikarbonil
-
Fumarna kiselina, izomerna sa maleinskom kiselinom
Akriloil grupa
[уреди | уреди извор]
α,β-Nezasićena karbonilna jedinjenja koja sadrže karbonil konjugovan sa alkenom koji je terminalni ili vinilni, sadrže akriloil grupu (H2C=CH−C(=O)−); to je acil grupa izvedena iz akrilne kiseline. Preferirani IUPAC naziv za grupu je prop-2-enoil, a poznat je i kao akrilil ili jednostavno (i netačno) kao akril. Jedinjenja koja sadrže akriloil grupu mogu se nazvati „akrilna jedinjenja”.
α,β-Nezasićene kiseline, estri i amidi
[уреди | уреди извор]α,β-nezasićena kiselina je vrsta α,β-nezasićenog karbonilnog jedinjenja koje se sastoji od alkena konjugovanog sa karboksilnom kiselinom.[3] Najjednostavniji primer je akrilna kiselina (CH2=CHCO2H). Ova jedinjenja su sklona polimerizaciji, što dovodi do velike površine poliakrilatne plastike. Akrilatni polimeri su izvedeni iz, ali ne sadrže akrilatnu grupu.[4] Karboksilna grupa akrilne kiseline može da reaguje sa amonijakom da bi se formirao akrilamid, ili sa alkoholom da bi se formirao akrilatni estar. Akrilamid i metil akrilat su komercijalno važni primeri α,β-nezasićenih amida i α,β-nezasićenih estara, respektivno. Takođe se lako polimerizuju. Akrilna kiselina, njeni estri i njeni derivati amida sadrže akriloilnu grupu.
α,β-Nezasićeni dikarbonili su takođe česti. Matična jedinjenja su maleinska kiselina i izomerna fumarna kiselina. Maleinska kiselina formira estre, imid i anhidrid, odnosno dietil maleat, maleimid i anhidrid maleinske kiseline. Fumarna kiselina, kao fumarat, je intermedijer u Krebsovom ciklusu limunske kiseline, što je od velikog značaja u bioenergiji.
Enoni
[уреди | уреди извор]Enon (ili alkenon) je organsko jedinjenje koje sadrži i alkenske i ketonske funkcionalne grupe. U α,β-nezasićenom enonu, alken je konjugovan sa karbonil grupom ketona.[3] Najjednostavniji enon je metil vinil keton (butenon,CH2=CHCOCH3). Enoni se obično proizvode pomoću aldolne kondenzacije ili Knoevenagelove kondenzacije. Neki komercijalno značajni enoni proizvedeni kondenzacijom acetona su mezitil oksid (dimer acetona) i foron i izoforon (trimeri).[5] U Mejer-Šusterovoma rearanžiranju, početno jedinjenje je propargil alkohol. Drugi metod za pristup α,β-nezasićenim karbonilima je eliminacija selenoksida. Ciklični enoni se mogu pripremiti putem Pauson-Handove reakcije.

Ciklični enoni
[уреди | уреди извор]Ciklični enoni uključuju ciklopropenon, ciklobutenon,[6] ciklopentenon, cikloheksenon i cikloheptenon.[7]
Enali
[уреди | уреди извор]Enal (ili alkenal) je organsko jedinjenje koje sadrži i alkenske i aldehidne funkcionalne grupe. U α,β-nezasićenom enalu, alken je konjugovan sa karbonil grupom aldehida (formil grupa).[3] Najjednostavniji enal je akrolein (CH2=CHCHO). Drugi primeri uključuju cis-3-heksenal (esencija pokošenih travnjaka) i cinamaldehid (esencija cimeta).
- Drugi α,β-nezasićeni karbonili
-
E-krotonaldehid, enal koji postoji kao izomer
-
Cikloheksenon, uobičajeni ciklični enon
-
testosteron, muški polni hormon
-
Cimetaldehid, esencija cimeta
-
Parahinon, posebno elektrofilni α,β-nezasićeni karbonil
-
Enonski kompleks gvožđe trikarbonila
Reakcije α,β-nezasićenih karbonila
[уреди | уреди извор]α,β-Nezasićeni karbonili su elektrofilni kako na karbonilnom ugljeniku tako i na β-ugljeniku. U zavisnosti od uslova, bilo koje mesto napadaju nukleofili. Dodaci alkenu se nazivaju konjugiranim adicijama. Jedna vrsta adicija konjugata je Majklova adicija, koja se komercijalno koristi u konverziji mezitil oksida u izoforon. Zbog svoje produžene konjugacije, α,β-nezasićeni karbonili su skloni polimerizaciji. U industrijskom obimu, polimerizacija dominira upotrebom α,β-nezasićenih karbonila. Opet zbog njihovog elektrofilnog karaktera, alkenski deo α,β-nezasićenih karbonila je dobar dienofil u Diels-Alderovim reakcijama. Oni se dalje mogu aktivirati Luisovim kiselinama, koje se vezuju za karbonil kiseonik. α,β-Nezasićeni karbonili su dobri ligandi za niskovalentne metalne komplekse, primeri su Fe(bda)(CO)3 i tris(dibenzilidenaceton)dipaladijum(0).
α,β-Nezasićeni karbonili se lako hidrogenišu. Hidrogenacija može ciljati karbonil ili alken (redukcija konjugata) selektivno, ili obe funkcionalne grupe.
Enoni se podvrgavaju Nazarovljevoj reakciji ciklizacije i Rahat-Karijerovoj reakciji (dimerizacija).
α,β-Nezasićeni tioestri
[уреди | уреди извор]α,β-Nezasićeni tioestri su intermedijeri u nekoliko enzimskih procesa. Dva istaknuta primera su kumaroil-koenzim A i krotonil-koenzim A. Oni nastaju delovanjem acil-KoA dehidrogenaza.[8] Flavin adenin dinukleotid (FAD) je neophodan kofaktor.

Bezbednost
[уреди | уреди извор]Pošto su α,β-nezasićena jedinjenja elektrofili i agensi za alkilovanje, mnoga α,β-nezasićena karbonilna jedinjenja su toksična. Endogeni kolektor glutationa prirodno štiti od toksičnih elektrofila u telu. Neki lekovi (amifostin, N-acetilcistein) koji sadrže tiol grupe mogu zaštititi od takve štetne alkilacije.
Reference
[уреди | уреди извор]- ^ Patai, Saul; Rappoport, Zvi, ур. (1989). Enones: Vol. 1 (1989). Patai's Chemistry of Functional Groups. ISBN 9780470772218. doi:10.1002/9780470772218.
- ^ Patai, Saul; Rappoport, Zvi, ур. (1989). Enones: Vol. 2 (1989). Patai's Chemistry of Functional Groups. ISBN 9780470772225. doi:10.1002/9780470772225.
- ^ а б в Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- ^ „Acrylic Acid and Derivatives”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. doi:10.1002/14356007.a01_161.pub2.
- ^ „Ketones”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. doi:10.1002/14356007.a15_077.
- ^ Ross, A. G.; Li, X.; Danishefsky, S. J. (2012). „Preparation of Cyclobutenone”. Organic Syntheses. 89: 491. doi:10.15227/orgsyn.089.0491
 .
.
- ^ Ito, Y.; Fujii, S.; Nakatuska, M.; Kawamoto, F.; Saegusa, T. (1979). „One-Carbon Ring Expansion of Cycloalkanones to Conjugated Cycloalkenones: 2-Cyclohepten-1-One”. Organic Syntheses. 59: 113. doi:10.15227/orgsyn.059.0113.
- ^ Thorpe, Colin; Kim, Jujng-Ja P. (1. 6. 1995). „Structure and mechanism of action of the Acyl-CoA dehydrogenases”. The FASEB Journal (на језику: енглески). 9 (9): 718—725. ISSN 0892-6638. PMID 7601336. S2CID 42549744. doi:10.1096/fasebj.9.9.7601336
 .
.