Еутектичка тачка
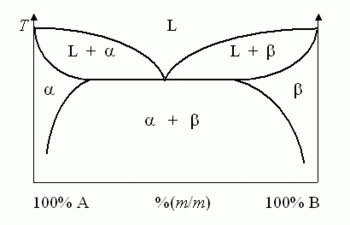
Еутектик или еутектичка смеша је смеша две или више чврсте фазе при саставу који има најнижу тачку топљења, и где се фазе истовремено кристализују из течног растопа на тој температури.[1] Однос фаза за одржавање еутектика се одређује применом правила полуге у еутектичкој тачки на бинарном фазном дијаграму. Термин долази од грч. eutektos, што значи лако топљив. Легуре са еутектичким саставом пролазе кроз еутектичку реакцију, тј. течна фаза очвршћују у више чврстих фаза.
Уравнотежени фазни дијаграм са десне стране приказује једноставни бинарни систем састављен од две компоненте, A i B, који има еутектичку тачку. Дијаграм показује релативну концентрацију компоненти А и B дуж X-осе, а температуру дуж Y-ose. Еутектичка тачка је тачка у којој течна фаза прелази директно у чврсту α + β фазу (чврста фаза састављена од A и B компоненте), што представља минималну температуру топљења за било коју могућу легуру од компоненти А и B. Температура, која одговара овој тачки, назива се еутектичка температура.
Сви бинарни системи немају еутектичку тачку. Неки системи формирају чврсти раствор при свим концентрацијама. Пример таквог система је злато-сребро.[2] Систем легуре, који има еутектик, се често назива еутектички систем или еутектичка легура.
Чврсти продукти еутектичке трансформације могу се лако идентификовати помоћу њихове ламеларне структуре.
Еутектоидна реакција
[уреди | уреди извор]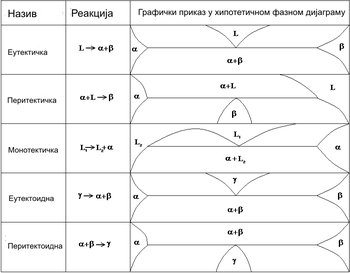
Еутектоидна реакција настаје када се једна чврста фаза директно трансформише у две, такође, чврсте фазе (γ→α+β). Типичан пример је реакција стварања перлита у челику: γ→α+Fe3C. На слици су приказане остале могуће реакције три фазе у бинарном систему.
Извори
[уреди | уреди извор]- ^ Smith & Hashemi 2006, стр. 326–327.
- ^ Ag - Au, Data from SGTE alloy database
Литература
[уреди | уреди извор]- Smith, William F.; Hashemi, Javad (2006). Foundations of Materials Science and Engineering (4th изд.). McGraw-Hill. ISBN 978-0-07-295358-9.
- Askeland, Donald R.; Pradeep P. Phule (2005). The Science and Engineering of Materials. Thomson-Engineering. ISBN 978-0-534-55396-8.
- Easterling, Edward (1992). Phase Transformations in Metals and Alloys. CRC. ISBN 978-0-7487-5741-1.
- Mortimer, Robert G. (2000). Physical Chemistry. Academic Press. ISBN 978-0-12-508345-4.
- Reed-Hill, R.E.; Abbaschian, Reza (1992). Physical Metallurgy Principles. Thomson-Engineering. ISBN 978-0-534-92173-6.
- Sadoway, Donald (2004). „Phase Equilibria and Phase Diagrams” (PDF). 3.091 Introduction to Solid State Chemistry, Fall 2004. MIT Open Courseware. Архивирано из оригинала (pdf) 20. 10. 2005. г. Приступљено 12. 4. 2006.
Спољашње везе
[уреди | уреди извор]

