Епителни тумор јајника
| Епителни тумори јајника | |
|---|---|
| Синоними | Сурфаце епитхелиал-стромал тумор |
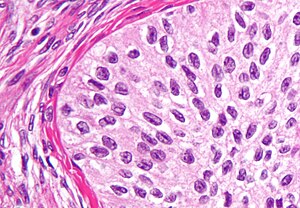 | |
| Микрографија Бренеровог тумора | |
| Специјалности | онкологија, акушерство и гинекологија |
Епителни тумори јајника (оваријума) (акроним ЕТЈ) чини 25% свих малигних обољења женског гениталног тракта и најчешћи је узрок смрти међу женама оболелим од малигне болести гениталног тракта. Према досадашњим саопштењима, најмање 20% епителних тумора јајника су карциноми, који се дијагностикују у стадијуму I болести. Епителни тумори представљају велики изазов за гинеколошког онколога, јер ненеопластичне лезије јајника могу створити карличну масу и потенцијално опонашати неоплазму. Њихово правилно препознавање и хистопатолошка класификација неопходни су за одговарајуће лечење, јер се малигни тумори обично јављају у поодмаклој фази због њихове асимптоматске природе и неприступачни места за аспирацијску цитологију и биопсију. I поред тоха хистопатолошки преглед и даље остаје главни ослонац у дијагнози ових неоплазми.
Услед тенденције да жене данас рађају своје прво дете у познијим репродуктивним годинама и веће доступности различитих дијагностичких метода, дијагноза епителних тумора јајника пре остваривања репродукције постаје све чешћа. Сходно томе, све су и већи захтеви струке да се хирургијом очува фертилитет у раним стадијумима епителних тумора јајника.[1]
Епидемиологија[уреди | уреди извор]

У жена свих добних скупина јајничке масе су честа појава, с приближно 8% асимптоматских жена у доби између 25 и 40 година. Око 80% тумора јајника је доброћудно, а јављају се углавном код младих жена између 20 и 45 година, док се гранични тумори јављају у нешто старијој доби.
Инциденција малигних тумора расте са годинама, јављајући се претежно у жена у менопаузи и перименопаузи.
Рак јајника је шести најчешћи рак међу женама, а уједно је и седми узрок смртности од рака међу женама широм света.[2][3] Јајници су трећа водећа локализација рака међу женама која је у заостатку иза рака врата матернице и рака дојке према неким регистрима за рак.[2][4]
Око 90% свих карцинома јајника и две трећине свих новотворина јајника чине тумори површинског епитела. Ови тумори имају широк спектар хистолошких образаца што га чини занимљивом темом за проучавање. Познавање врсте тумора и диференцијација помаже у разумном управљању пацијентом у смислу одговарајућег лечења и праћења.[5][6][7]
Међу епителни оваријалним туморима најопаснији су карциноми (ЕОК) који чине 25% свих малигних обољења женског гениталног тракта и најчешћи су узрок смрти међу женама оболелим од малигне болести гениталног тракта.[8] Међу ЕОК, инвазивни муцинозни аденокарцином јавља се код око 10% оболелих.[9] Према досадашњим саопштењима, бар 20% дијагностикује се у стадијуму I болести.[8][10]
Десетогодишња стопа преживљавања жена оболелих од муцинозних тумора је одлична у одсуству инвазије. У случају граничних тумора ограничених на јајнике и малигних тумора без инвазије, стопе преживљавања су 90% или веће. Код инвазивних карцинома преживљавање је приближно 30%.
Класификација[уреди | уреди извор]

Епително-стромални тумори јајника су класификовани на основу типа епителне ћелије, релативне количине епитела и строме, присуства папиларних процеса и локације епителних елемената.[11]
Микроскопске патолошке особине одређују да ли је површински епително-стромални тумор бенигни, гранични или малигни (доказ малигнитета и стромалне инвазије). Гранични тумори су неизвесног малигног потенцијала.
Ову групу чине серозни, муцинозни, ендометриоидни, бистроћелијски и Бренеров (прелазни) тумори, мада постоји неколико мешовитих, недиференцираних и некласификованих типова.[12][13][14][15]
Серозни тумори[уреди | уреди извор]
Хистопатологија облоге бенигног серозног тумора јајника.
Бенигни серозни тумори јајника су једноструке цисте танких зидова које су обложене трепљичастим псеудостратификованим кубоидним или стубастим епителом.[16]
Ови тумори варирају у величини, од малих и готово неприметних до великих, испуњавајући трбушну шупљину.
Бенигни, гранични и малигни типови серозних тумора чине око 30% свих тумора јајника.
Око 75% је бенигних или граничних малигнитета, а 25% је малигних
Малигни облик овог тумора, серозни цистаденокарцином, чини приближно 40% свих карцинома јајника и најчешћи су малигни тумори јајника.
Бенигни и гранични тумори су најчешћи су у доби између 20 и 50 година.
Малигни серозни тумори јављају се у просеку касније у животу, мада нешто и раније у породичним случајевима.[17]
Око 20% бенигних, 30% граничних и 66% малигних тумора је обострано (погађа оба јајника).
Компоненте ових тумора могу да укључују:
- цистична подручја
- цистична и влакнаста подручја
- претежно влакнаста подручја
Шанса за малигнитет тумора расте са количином присутних чврстих подручја, укључујући и папиларне структуре и било које присутно некротичног ткива.
Патологија[уреди | уреди извор]

- Ова врста тумора обложена је високим, стубичастим и трепљастим епителним ћелијама.
- Испуњен је бистром серозном течношћу
- Појам сероза који описује течности цисте, почео је да се примеwњује за одређени тип епителне ћелије виђен у овим туморима
- може захватити површину јајника.[18]
Подела између бенигних, граничних и малигних утврђује се проценом:[19]
- ћелијска атипија (без обзира да ли појединачне ћелије изгледају абнормално)
- инвазија строме околних јајника (било да се ћелије инфилтрирају у околно ткиво или не)
- гранични тумори могу имати ћелијску атипију, али нема доказа о инвазији,
- присуство тела псамома је карактеристичан микроскопски налаз цистаденокарцинома.[20]
Прогноза[уреди | уреди извор]
Прогноза серозног тумора, као и већина неоплазми, зависи од:
- степен диференцијације
- колико блиске туморске ћелије подсећају на бенигне ћелије
- добро диференцирани тумор веома личи на бенигне туморе
- слабо диференцирани тумор можда уопште не подсећа на тип порекла ћелије
- умерено диференцирани тумор обично подсећа на ћелијски тип порекла, али делује искрено малигно
- проширење тумора на друге структуре
- посебно код серозних малигних болести, присуство малигног ширења на перитонеум је важно с обзиром на прогнозу.
Петогодишња стопа преживљавања граничних тумора и малигних тумора ограничених на јајнике износи 100%, односно 70%. Ако је захваћен перитонеум, ове стопе постају 90% и 25%.
Иако су петогодишње стопе преживљавања граничних тумора одличне, ово не треба сматрати доказом излечења, јер се рецидиви могу јавити много година касније.
Муцинозни тумори[уреди | уреди извор]

Муцинозни тумори зразито подсећају на њихове серозне колеге, али вероватно неће бити билатерални
Нешто ређе, чини око 25% свих новотворина на јајницима
У неким случајевима муцинозне туморе карактеришу више циста променљиве величине и реткост површинског захваћања у поређењу са серозним туморима
Такође у поређењу са серозним туморима, муцински тумори су ређе обострани, приближно 5% примарних муцинозних тумора је обострано.
Може формирати врло велике цистичне масе, са забележеном тежином већом од 25 кг
Патологија[уреди | уреди извор]
Муцинозне туморе карактерише облога високих ћелијских епителних ћелија са апикалним муцином и одсуством трепавица, сличних по изгледу са бенигним цервикалним или цревним епителом. Изглед може изгледати слично раку дебелог црева или јајника, али типично потиче из слепог црева (види муцинозни аденокарцином са клиничким стањем Псеудомикома перитонеи). Јасна стромална инвазија користи се за разликовање граничних тумора од малигних.
Прогноза[уреди | уреди извор]
Стопе преживљавања од 10 година за граничне туморе садржане у јајнику, малигне туморе без инвазије и инвазивне малигне туморе веће су од 95%, 90%, односно 66%. Једно ретко, али вредно пажње, повезано са муцинозним новотворинама јајника је псеудомиксом перитонеј. Како су примарни муцинозни тумори јајника обично једнострани (у једном јајнику), презентација билатералних муцинозних тумора захтева изузеће не-јајничког порекла, обично слепог црева.
Ендометриоидни тумори[уреди | уреди извор]
Ендометриоидни тумори јајника могу бити бенигни, са пролиферацијом и малигни.
- Бенигни ендометриоидни тумори
Бенигни ендометриоидни тумори су релативно ретки и обично се јављају обострано. Достижу величину женске песнице и изазивају запаљењску реакцију на својој површини, па су често срасли са околином. Због тога се код ових тумора не јавља компликација у виду торзије. По грађи потичу од ткива ендометријума чије порекло у овим туморима није разјашњено. Постоји више хипотеза о томе. У сваком случају ћелије ендометријума из којих потичу ови тумори, задржавају своје функционалне особине и под утицајем сексуалних хормона у њима се дешавају редовне цикличне промене, праћене крварењем. На тај начин садржај цисте добија хеморагичан карактер и касније поприма чоколадну боју или боју катрана. Пацијенткиње осећају дисменореичне тегобе, а често пате од диспареуније. Такође, ови тумори могу бити узрок неплодности.
Ендометриоидни тумори могу по хистолошкој грађи бити:
- аденоми, у облику солидних тумора,
- цистаденоми, у облику мешовитих солидно цистичних тумора
- Тумори са пролиферацијом
Неки од тумора јајника спадају у гранично малигне туморе туморе са пролиферацијама, чије ћелије показују извесне особине својствене малигним неоплазмама. Ови тумори временом постају прави малигни тумори ендометриоидни аденокарђноми.
- Малигни ендометриоидни тумори
Ендометриоидни тумори цистични или солидни могу бити малигни од самог почетка (ендометроидни карциноми), и чине приближно 20% свих карцинома јајника Направљене су од цевастих жлезда које подсећају на бенигни или малигни ендометријум. Од 15 до 30% ендометриоидних карцинома јајника јавља се код особа са карциномом ендометријума и ови пацијенти имају лошију прогнозу. Изгледају слично осталим површинским епително-стромалним туморима, са чврстим и цистичним подручјима. Око 40% ових тумора је обострано, када су обостране метастазе често присутне.
Патологија[уреди | уреди извор]
Бенигни тумори имају зреле жлезде у фиброзној строми.
Гранични тумори имају сложен образац гранања без стромалне инвазије.
Карциноми (малигни тумори) имају инвазивне жлезде са препуним, атипичним ћелијама, честим митозама. Са лошијом диференцијацијом, тумор постаје чвршћи (компактнији).
Прогноза[уреди | уреди извор]
Прогноза у многоме зависи од ширења тумора, као и од тога колико се тумор разликује. Укупна прогноза је нешто лошија него за серозне или муцинозне туморе, а петогодишња стопа преживљавања код пацијената са туморима ограниченим на јајник износи приближно 75%.
Бистроћелијски тумори[уреди | уреди извор]

Бистроћелијске туморе карактеришу велике епителне ћелије са обилном бистром цитоплазмом и могу се видети у вези са ендометриозом или ендометриоидним карциномом јајника, што има сличност са карциномом бистрих ћелија ендометријума. Могу бити претежно чврсти или цистични. Ако су чврсте, бистре ћелије имају тенденцију да буду распоређене у чаршаве или тубуле. Код цистичне сорте, неопластичне ћелије чине облогу цисте.
Прогноза[уреди | уреди извор]
Ови тумори имају тенденцију да буду агресивни, петогодишња стопа преживљавања тумора ограничених на јајнике износи приближно 65%. Ако се тумор приликом дијагнозе проширио изван јајника, прогноза је лоша
Бренеров тумор[уреди | уреди извор]

Бренерови тумори су неуобичајени тумори површинских епителних стромалних ћелија у којима је епителна ћелија (која дефинише ове туморе) прелазна ћелија. По изгледу су слични епителима бешике. Тумори могу бити врло мали до врло велики и могу бити чврсти или цистични. Хистолошки се тумор састоји од гнезда поменутих прелазних ћелија унутар околног ткива које подсећа на нормалан јајник. Бренерови тумори могу бити бенигни или малигни, у зависности од тога да ли туморске ћелије нападају околно ткиво.[22][23][24]
Тумори малих ћелија[уреди | уреди извор]
Двоћелијски рак јајника (СЦЦО) обично се класификују у епителне туморе[тражи се извор] повезане са препознатљивим ендокриним карактеристикама.[25]
Светска здравствена организација (ВХО) препознаје СЦЦО као два различита ентитета: рак јајника малих ћелија хиперкалцемичног типа (СЦЦОХТ) и рак јајника малих ћелија плућног типа (СЦЦОПТ).[25]
Ситноћелијски тумори су ретки и агресивни, они доприносе мање од 2% свих гинеколошких малигних болести.[25] Просечна старост дијагнозе је 24 године, а већина пацијената такође има хиперкалцемију (62%).[26] Типично се јавља са једностраним великим тумором.[26] Већина жена умире у року од годину дана од постављања дијагнозе.[26]
Дијагноза[уреди | уреди извор]
Напредак у молекуларној биологији и велика количина литературе о употреби помоћних техника за боље разумијевање тумора површинског епитела јајника су у порасту, али још увијек су морфолошке студије хистопатолошким техникама и даље окосница за дијагнозу ових тумора.[27][28]
Хистопатолошка дијагноза тумора јајника заснива се на одређивању из узорка ћелијског типа тумора. На основу типова ћелија, према једној студији из Индије,[27] дијагностиковано је 61,7% серозних тумора, 34,8% муцинозних тумора, један карцином бистрих ћелија, један ендометриоидни карцином и 3 бенигна тумора пријелазних ћелија. Учесталост појаве ових тумора из ове студије упоредива са студијама које су радили други истраживачи.[29][30][31][32]
Терапија[уреди | уреди извор]
Истраживања сугеришу да се у првој линији за лечења рака јајника ендометријума користи пегиловани липосомски доксорубицин заједно са карбоплатином, задовољавајућа алтернатива паклитакселу са карбоплатином.[33] Код особа са релапсом ЕОЦ осетљивим на платину, истраживање је открило да је пегиловани липосомски доксорубицин са карбоплатином бољи третман од паклитаксела са карбоплатином.[34]
За узнапредовале облике ове хистологије, Амерички национални институт за рак препоручује метод хемотерапије који комбинује интравенску (IV) и интраперитонеалну (ИП) администрацију.[35] Пожељна хемотерапеутска средства укључују платину са таксаном.
Према водичима Интернационалне асоцијације за гинекологију и акушерство (ФИГО) стандардни третман жена са епителним оваријалним карциномом састоји се од комплетног хируршког стадирања које подразумева:[1]
- тоталну абдоминалну хистеректомију,
- билатералну салпингоофоректомију,
- дисекцију пелвичних и парааортних лимфних чворова,
- инфраколичну оментектомију,
- мултиплу пелвичну цитологију испирака,
- мултипле перитонеалне биопсије,
- максималну циторедуктивну хирургију.
Стандардни хируршки поступак, међутим, болесницу у потпуности лишава фертилности.
Промене става о радикалној онколошкој хирургији, вођене су са идејом да не би требало одређивати користи само према контроли болести, већ и према квалитету живота, а пре свега према очувању фертилности млађих болесница са карциномом оваријума.[36]
Због тенденције да жене данас рађају своје прво дете у познијим репродуктивним годинама и веће доступности различитих дијагностичких метода, дијагноза ЕОК пре остваривања репродукције постаје све чешћа. Сходно томе, све су већи захтеви за хирургијом очувања фертилитета у раним стадијумима ЕОК.[1]
Да ли је комплетно хируршко стадирање увек неопходно?[уреди | уреди извор]
У студији Цхо и сар.[37] утврђено је да су морбидитет и инциденција постоперативних компликација били виши код комплетно стадираних, него некомплетно стадиране болеснице. Хистолошки подтип тумора требало би да утиче на процедуре које захтева хируршко стадирање. Ова студија односила се на муцинозне аденокарциноме стадијума I, међу болесницама које нису биле иницијално хируршки стадиране; 5,9% њих било је супстадирано у односу на перитонеалну цитологију, а није било супстадираних у погледу присуства окултних лимфнонодусних метастаза. Они су, такође, утврдили да нема значајних разлика у рекурентности, периоду без болести и укупном преживљавању у односу на комплетност стадирања код болесница са муцинозним аденокарциномом у стадијуму I болести. Ови аутори сматрају да комплетно хируршко стадирање са дисекцијом лимфних чворова нема утицаја на преживљавање болесница са муцинозним аденокарциномом у стадијуму I болести и да би, вероватно, могло бити изостављено код ових болесница.[38]
Метастазе[уреди | уреди извор]
За површинске епително-стромалне оваријалне туморе (посебно карциноме), најчешћа места метастазирања су, у:[39]
- 33% случајева плеурална шупљина,
- 26% случајева јетра плућа
- 3% случаја плућа.
Утицај на плодност[уреди | уреди извор]
Плодност након третмана површинских епителних оваријалних тумора углавном зависи од хистологије и почетног стадијума тумора који се деле на бенигнији, и оне у напреднијим стадијума (или више малигне).[40]
Процењује се да конзервативно лечење (без билатералне оофоректомије) граничних тумора у раној фази има шансу за преко 50% спонтаних трудноћа са малим ризиком од појаве смртносне поновне појаве тумора (0,5%).[40] С друге стране, у случајевима конзервативног лечења у поодмаклој фази граничних тумора, процењује се да су стопе спонтане трудноће 35%, а ризик од леталног рецидива 2%.[40]
Инциденција метастаза у лимфним чворовима код болесница у стадијуму I муцинозног аденокарцинома износила је 3%, у поређењу са 27% код оних са серозним аденокарциномом 20.
Прогноза[уреди | уреди извор]
Прогноза серозног тумора, као и већина неоплазми, зависи од степен диференцијације и обима малигног проширење тумора на друге структуре посебно код серозних малигних обољења, присуство малигног ширења на перитонеум је важно с обзиром на прогнозу.[41]
Петогодишња стопа преживљавања граничних и малигних тумора ограничених на јајнике износи 100%, односно 70%. Ако је захваћен перитонеум, ове стопе постају 90% и 25%.
Иако су петогодишње стопе преживљавања граничних тумора одличне, ово не треба сматрати доказом излечења, јер се рецидиви могу јавити много година касније.
Извори[уреди | уреди извор]
- ^ а б в Милошевић Ј, ет ал.Трудноћа након конзервативног хируршког лечења муцинозног аденокарцинома јајника, Војносанитетски преглед 2011; 68(1): 77–80.
- ^ а б Глобал цанцер статистицс, 2002. Паркин ДМ, Браy Ф, Ферлаy Ј, Писани П ЦА Цанцер Ј Цлин. 2005 Мар-Апр; 55(2):74-108.[ПубМед] [Реф лист]
- ^ Студy оф 'паттернс оф царе' оф овариан цанцер патиентс ин а специализед цанцер институте ин Колката, еастерн Индиа. Басу П, Де П, Мандал С, Раy К, Бисwас Ј Индиан Ј Цанцер. 2009 Јан-Мар; 46(1):28-33.
- ^ Цонсолидатед Репорт оф Популатион Басед Цанцер Регистриес 2001-2004. Натионал Цанцер Регистрy Програм Бангалоре: Индиан Цоунцил оф Медицал Ресеарцх. 2006. [Реф лист]
- ^ Тавассоли ФА, Девилее П. Тумоурс оф Бреаст анд Фемале Генитал Органс. Лyон: ИАРЦ Пресс; 2003. WХО цлассифицатион оф тумоурс. Патхологy анд Генетицс. [Гоогле Сцхолар]
- ^ Цлемент ПБ, Yоунг ХР. Стернберг’с Диагностиц Сургицал Патхологy, 5тх Едитион. Овариан Сурфаце Епитхелиал-Стромал Тумоурс. Липпинцотт Wиллиамс & Wилкинс; 2010. пп. 2272–306. [Гоогле Сцхолар]
- ^ Сцуллy РЕ. Интернатионал Хистологицал Цлассифицатион оф Тумоурс: Хистологицал Тyпинг оф Овариан Тумоурс. 2нд едитион. Хеиделберг: Спрингер-Верлаг; 1998. [Гоогле Сцхолар]
- ^ а б Јемал А, Сиегел Р, Wард Е, Мурраy Т, Xу Ј, Смигал C, ет ал. Цанцер статистицс, 2006. ЦА Цанцер Ј Цлин 2006; 56(2): 106–30.
- ^ МцГуире V, Јессер ЦА, Wхиттеморе АС. Сурвивал амонг У.С. wомен wитх инвасиве епитхелиал овариан цанцер. Гyнецол Онцол 2002; 84(3): 399–403
- ^ Греен ЈА. Еарлy овариан цанцер-тиме фор а ретхинк он стаге? Гyнецол Онцол 2003; 90(2): 235–7.
- ^ „Бенигн Овариан Сурфаце Епитхелиал-Стромал Тумор”. www.еби.ац.ук. Приступљено 2021-03-25.
- ^ Исхиока С-I, Сагае С, Терасаwа К, Сугимура M, Нисхиока Y, Тсукада К, Кудо Р. Цомпарисон оф тхе усефулнесс бетwеен а неw универсал градинг сyстем фор епитхелиал овариан цанцер анд тхе ФИГО градинг сyстем. Гyнецол Онцол 2003;89:447-452.
- ^ Каимактцхиев V, Террацциано L, Торнилло L, Спицхтин Х, Стоиос D, Бунди M, Корцхева V, Мирлацхер M, Лода M, Саутер Г, Цорлесс CL. Тхе хомеобоx интестинал дифферентиатион фацтор ЦДX2 ис селецтивелy еxпрессед ин гастроинтестинал аденоцарциномас. Мод Патхол 2004;17:1392-1399.
- ^ Курман РЈ, Схих ЛМ. Патхогенесис оф овариан цанцер. Лессонс фром морпхологy анд молецулар биологy анд тхеир цлиницал имплицатионс. Инт Ј Гyнецол Патхол 2008;27:151- 160.
- ^ Логани С, Олива Е, Амин МБ, Фолпе АЛ, Цохен C, Yоунг РХ. Иммунопрофиле оф овариан туморс wитх путативе транситионал целл (уротхелиал) дифферентиатион усинг новел уротхелиал маркерс. Хистогенетиц анд диагностиц имплицатионс. Ам Ј сург патхол 2003;27:1434-1441.
- ^ Барадwан, Саеед; Алалyани, Ханеен; Барадwан, Амира; Барадwан, Афнан; Ал-Гхамди, Марам; Алнемари, Јамеел; Ал-Јароуди, Даниа (2018). "Билатерал овариан массес wитх дифферент хистопатхологy ин еацх оварy". Цлиницал Цасе Репортс. 6 (5): 784–787.
- ^ МцЦлуггаге WГ, Лyнесс РW, Аткинсон РЈ, Доббс СП, Харлеy I, МцЦлелланд ХР, Прице ЈХ. Морпхологицал еффецтс оф цхемотхерапy он овариан царцинома. Ј Цлин Патхол 2002;55:27-31.
- ^ Доббс СП, МцЦлелланд РХ, Кеннедy К, МцЦлуггаге WГ. Ан иммунохистоцхемицал анд морпхологицал аналyсис оф паст-цхемотхерапy овариан царцинома. Ј цлин Патхол 2008;61:652-657.
- ^ МцЦлуггаге WГ. Тхе патхологy оф анд цонтроверсиал аспецтс оф овариан бордерлине тумоурс. Цурр Опин Онцол 2010; 22:462-472. Миллер К, Прице ЈХ,
- ^ Цотран РС, Кумар V, Нелсон Ф, Роббинс СЛ, Аббас АК (2005). Роббинс анд Цотран патхологиц басис оф дисеасе (7тх ед.). Ст. Лоуис, Мо: Елсевиер Саундерс. . ИСБН 978-0-7216-0187-8. Недостаје или је празан параметар
|титле=(помоћ). - ^ Барадwан, Саеед; Алалyани, Ханеен; Барадwан, Амира; Барадwан, Афнан; Ал-Гхамди, Марам; Алнемари, Јамеел; Ал-Јароуди, Даниа (2018). „Билатерал овариан массес wитх дифферент хистопатхологy ин еацх оварy”. Цлиницал Цасе Репортс. 6 (5): 784—787. ПМЦ 5930217
 . ПМИД 29744056. дои:10.1002/ццр3.1466.
. ПМИД 29744056. дои:10.1002/ццр3.1466.
- ^ Ф. Бреннер: Дас Оопхорома фоллицуларе. Франкфуртер Зеитсцхрифт фüр Патхологие, Мüнцхен, 1907, 1: 150-171.
- ^ Пхилипп, Еллиот Елиас; О'Доwд, Мицхаел Ј. (2000). Тхе хисторy оф обстетрицс анд гyнаецологy. Царнфортх, Ланцс: Партхенон. п. 586
- ^ Пелуси Г, Тарони Б, Фламигни C. Бенигн овариан туморс. Фронт Биосци 1996;1:16-9.
- ^ а б в Капхан АА, Цастро CM (2014-01-01). МПХ рГ, ФРЦПАТХ РХ, MD ЈО, MD МЈ (едс.). Смалл Целл анд Неуроендоцрине Цанцерс оф тхе Оварy. Јохн Wилеy & Сонс, Лтд. пп. 139–147. Капхан, Ариел А.; Цастро, Цесар M. (2014). „Смалл Целл анд Неуроендоцрине Цанцерс оф тхе Оварy”. Унцоммон Гyнецологиц Цанцерс. стр. 139—147. ИСБН 9781118655351. дои:10.1002/9781118655344.цх12.. . ИСБН 9781118655344. Недостаје или је празан параметар
|титле=(помоћ). - ^ а б в Бакхру А, Лиу ЈР, Лагстеин А (2012). "А цасе оф смалл целл царцинома оф тхе оварy хyперцалцемиц вариант ин а теенагер". Бакхру, Арвинд; Лиу, Ј. Ребецца; Лагстеин, Амир (2012). „А цасе оф смалл целл царцинома оф тхе оварy хyперцалцемиц вариант ин а теенагер”. Гyнецологиц Онцологy Цасе Репортс. 2 (4): 139—142. ПМЦ 3861231
 . ПМИД 24371647. дои:10.1016/ј.гyнор.2012.09.001.
. ПМИД 24371647. дои:10.1016/ј.гyнор.2012.09.001.
- ^ а б Модепалли, Налини; Венугопал, Сугуна Белур (1. 10. 2016). „Цлиницопатхологицал Студy оф Сурфаце Епитхелиал Тумоурс оф тхе Оварy: Ан Институтионал Студy”. Јоурнал оф Цлиницал анд Диагностиц Ресеарцх : ЈЦДР. 10 (10): ЕЦ01—ЕЦ04. ИССН 2249-782X. ПМЦ 5121679
 . ПМИД 27891341. дои:10.7860/ЈЦДР/2016/21741.8716.
. ПМИД 27891341. дои:10.7860/ЈЦДР/2016/21741.8716.
- ^ Зхао C, Браттхауер ГЛ, Барнер Р, Ванг Р. Диагностиц утилитy оф WТ1 иммуностианинг ин овариан Сертоли целл тумор. Ам Ј Сург Патхол 2007;31:1378-1386.
- ^ Кантхикар СН, Дравид НВ, Деоре ПН, Никумбх ДБ, Сурyаwансхи КХ. Цлиницо-Хистопатхологицал аналyсис оф неопластиц анд нон-неопластиц лесионс оф тхе оварy: А 3-Yеар проспецтиве студy ин Дхуле, Нортх Махарасхтра, Индиа. Јоурнал оф Цлиницал анд Диагностиц Ресеарцх : ЈЦДР. 2014;8(8):ФЦ04–ФЦ07. [ПМЦ фрее артицле] [ПубМед] [Гоогле Сцхолар]
- ^ >Даwар Р. Сурфаце епитхелиал тумоурс оф оварy. Индиан Јоурнал оф Медицал & Паедиатриц Онцологy. 2004;25(1):5–9. [Гоогле Сцхолар]
- ^ Тусхар К, Асанрантхи К, Мохапатра ПЦ. Интраоперативе цyтологy оф овариан тумоурс. Ј Обстет Гyнецол Индиа. 2005;55(4):345–49. [Гоогле Сцхолар]
- ^ Сwамy ГГ, Сатyанараyана Н. Цлиницопатхологицал аналyсис оф овариан тумоурс – А студy он фиве yеарс самплес. Непал Медицал Цоллеге Јоурнал. 2010;12(4):221–23.
- ^ Лаwрие ТА, Раббие Р, Тхома C, Моррисон Ј, ет ал. (Тхе Цоцхране Цоллаборатион) (Оцтобер 2013). Лаwрие ТА (ед.). "Пегyлатед липосомал доxорубицин фор фирст-лине треатмент оф епитхелиал овариан цанцер". Тхе Цоцхране Датабасе оф Сyстематиц Ревиеwс. Јохн Wилеy & Сонс, Лтд (10): ЦД010482. Лаwрие, Тхереса А.; Раббие, Роy; Тхома, Цлеменс; Моррисон, Јо (2013). „Пегyлатед липосомал доxорубицин фор фирст-лине треатмент оф епитхелиал овариан цанцер”. Ур.: Лаwрие, Тхереса А. Цоцхране Датабасе оф Сyстематиц Ревиеwс. 2013. стр. ЦД010482. ПМЦ 6457824
 . ПМИД 24142521. дои:10.1002/14651858.цд010482.пуб2..
. ПМИД 24142521. дои:10.1002/14651858.цд010482.пуб2..
- ^ Лаwрие, Тхереса А.; Брyант, Андреw; Цамерон, Алисон; Граy, Емма; Моррисон, Јо (2013). „Пегyлатед липосомал доxорубицин фор релапсед епитхелиал овариан цанцер”. Цоцхране Датабасе оф Сyстематиц Ревиеwс. 2016 (9): ЦД006910. ПМЦ 6457816
 . ПМИД 23835762. дои:10.1002/14651858.цд006910.пуб2..
. ПМИД 23835762. дои:10.1002/14651858.цд006910.пуб2..
- ^ „Интраперитонеал Тхерапy фор Овариан Цанцер - Натионал Цанцер Институте”. 2009-01-13. Архивирано из оригинала 13. 01. 2009. г. Приступљено 2021-03-15.
- ^ Парк ЈY, Ким ДY, Сух ДС, Ким ЈХ, Ким YМ, Ким YТ, ет ал. Оутцомес оф фертилитy-спаринг сургерy фор инвасиве епитхелиал овариан цанцер: онцологиц сафетy анд репродуцтиве оутцомес. Гyнецол Онцол 2008; 110(3): 345–53.
- ^ Цхо YХ, Ким ДY, Ким ЈХ, Ким YМ, Ким КР, Ким YТ, ет ал. Ис цомплете сургицал стагинг нецессарy ин патиентс wитх стаге I муциноус епитхелиал овариан туморс? Гyнецол Онцол 2006; 103: 878–82.
- ^ 20. Ди Ре Ф, Фонтанели Р, Распаглиеси Ф, Ди Ре Е. Пелвиц анд парааортиц лyмпхаденецтомy ин цанцер оф тхе оварy. Баиллиéрес Цлин Обстет Гyнаецол 1989; 3: 131–42.
- ^ Коломаинен, Десирее Ф.; Ларкин, Јамес M.Г.; Бадран, Мохаммад; а'Херн, Рогер П.; Кинг, D. Мицхаел; Фисхер, Цyрил; Бридгес, Јане Е.; Блаке, Петер Р.; Бартон, Десмонд П.Ј.; Схепхерд, Јохн Х.; Каyе, Станлеy Б.; Горе, Мартин Е. (2002). „Епитхелиал Овариан Цанцер Метастасизинг то тхе Браин: А Лате Манифестатион оф тхе Дисеасе wитх ан Инцреасинг Инциденце”. Јоурнал оф Цлиницал Онцологy. 20 (4): 982—986. ПМИД 11844820. дои:10.1200/ЈЦО.2002.20.4.982..
- ^ а б в Дараï, Емиле; Фаувет, Раффаèле; Узан, Цатхерине; Гоуy, Сéбастиен; Дувиллард, Пиерре; Морице, Пхилиппе (2013). „Фертилитy анд бордерлине овариан тумор: А сyстематиц ревиеw оф цонсервативе манагемент, риск оф рецурренце анд алтернативе оптионс”. Хуман Репродуцтион Упдате. 19 (2): 151—166. ПМИД 23242913. дои:10.1093/хумупд/дмс047..
- ^ Сломовитз БМ, Цапуто ТА, Гретз ХФ III, Ецономос К, Торториелло DV, Сцхлоссхауер ПW, Баерген РН, Исацсон C, Сослоw РА. А цомпаративе аналyсис оф 57 сероус бордерлине туморс wитх анд wитхоут а нонинвасиве мицропапилларy цомпонент. Ам Ј Сург Патхол 2002;26:592-600.
Литература[уреди | уреди извор]
- Е. Г. Ортхманн: Зур Цасуистик еинигер селтенер Овариал- унд Тубен-Туморен. Монатссцхрифт фüр Гебуртсхüлфе унд Гyнäкологие, Берлин, 1899, 9: 771-782.
- Е. Г. Ортхманн: Üбер дие Ентстехунгсwеисен дер Сацросалпинген унд Тубо-Овариалцyстен. [Вирцхоwс] Арцхив фüр патхологисцхе Анатомие унд Пхyсиологие, унд фüр клинисцхе Медизин, Берлин, 1899, 155: 220-234.
- Дукиц M, Јурисиц А, Марковиц С, Ракиц С, Руниц С, Анделић С. Дијагностићка вредност колор доплер ултрасонографије у откривању малигних тумора оваријума. Зборник радова XL гинекол. акус. нед, Београд: 1996;409-15.
Спољашње везе[уреди | уреди извор]
| Класификација |
|---|
- Јохнс Хопкинс: "Сурфаце Епитхелиал Туморс" Архивирано на сајту Wayback Machine (19. фебруар 2020) (језик: енглески)
- Диаграм: "Епитхелиал Стромал Овариан Туморс" (језик: енглески)
- Смалл Целл Овариан Цанцер Ресеарцх Цоллаборатион & Патиентс Регистрy Архивирано на сајту Wayback Machine (14. фебруар 2019) (језик: енглески)
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
