Нервно-мишићна веза
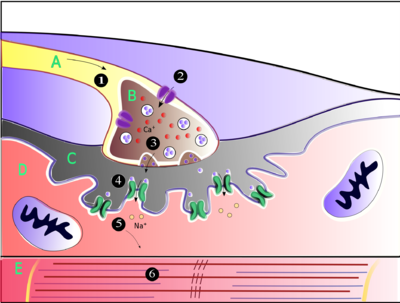
(1) акцијски потенцијал стиже на врх аксона.
(2) Прекидач који зависи од калцијума отвара „врата“, омогућавајући калцијуму улазак у аксонски терминал.
(3) Осигурач неуротрансмитерске везикуле са пресинапсне мембране омогућава да и ацетилхолин (АЦх) уђе у синапсну пукотину путем егзоцитозе.
(4) АЦх се веже за постсинапсне рецепторе на сарколеми.
(5) Ова веза узрокује измену јона и отварање јонских канала и омогућава натријевим јонима да теку кроз мембрану у мишићну ћелију. (6) Проток натријумових јона кроз мембрану у мишићну ћелију генерише акцијски потенцијал који путује у миофибриле и резултатира у контракцији мишића.
Ознаке: А - Аксон моторног неурона; Б - Аксонски терминал. C - Синапсна пукотина. D - Мишићне ћелије. Е - Дио миофибрила
Нервно-мишићна веза (или мионервна веза / неуромишићна веза / неуромишићни спој) је хемијска синапса која се формира у контакту између моторног неурона и мишићних влакана. То је неуромишићна спојница која моторном неурону омогућава пренос сигнала до мишићних влакана, узрокујући мишићну контракцију.[1][2]
Преглед[уреди | уреди извор]
За нормалну функцију, мишићима је потребан одговарајући сигнал, чак и за само одржавање тонуса мишића, избјегавајући атрофију. Синапсне трансмисије на неуромишићној вези почињу када акциони потенцијал достигне пресинапсни терминал моторног неурона, чије активирање напона зависи од калцијумовог канала како би се јонима калцијума омогућио улазак у неурон. Калцијумови јони се везују за протеине сензора (синаптотагмин) на синаптичким везикулама, што је изазива да се оне споје са ћелијском мембраном и накнадно ослобађају неуротрансмитере из моторног неурона у синапсну пукотину. Код кичмењака, моторни неурони отпуштају ацетилхолин (АЦх), мало-молекулски неуротрансмитер, који се распршује преко синапсне пукотина и везује за никотински ацетилхолски рецептор (нАЦхРс) на ћелијској мембрани мишићних влакана, познатој као сарколема. Јонотропни рецептори су нАЦхРс, што значи да служе као лиганд-контролисани јонски канали. Везивање АЦХ за рецептор може деполаризирати мишићна влакна, узрокујући каскаду која на крају резултира у мишићној контракцији.[3][4][1][5]
Болести неуромишићних веза могу бити генетичког и аутоимуног поријекла. Генетички поремећаја, као што је Дуцхенне мишићна дистрофија, могу настати због присуства мутираних структурних протеина који чине неуромишићне везе, а аутоимунске болести, као што је ‘’миастенија гравис’’, настају када се производе антитела против никотинских рецептора ацетилколина на сарколеми.
Структура и функција[уреди | уреди извор]

Неуромишићна веза или спојница се разликује од хемијских синапси између неурона. Пресинаптички моторни аксон се завршава на 30 нанометара од сарколеме, ћелијске мембране мишићне ћелије. Овај 30-нанометарски простор чини синапсну пукотину кроз коју се ослобађају сигналне молекуле. Сарколема има улегнуће (инвагинацију) под називом постсинапсни набор, који повећава површину мембране изложене синаптичке пукотина. Ови набори чине оно што се назива моторна (крајња) плоча, који поседују рецепторе никотинског ацетилхолина (нАЦхРс), густоће од 10.000 рецептора / микрометар2 (у скелетним мишићима).
Пресинапсни аксон има испупчења звана терминална дугмад (или пресинапсни терминал) који се пројектују у поствезним наборима сарколеме. Пресинапсни терминали имају активне зоне које садрже везикуле, кванти, пуне молекула ацетилколина. Ове везикуле могу бити пресинапсни осигурач мембране и испуштати молекуле АЦх у синапсну пукотину путем егзоцитозе након деполаризације. АЦхРс су локализоване на супротној страни пресинаптичких терминала протеинске скеле на поствезним наборима сарколеме. Дистрофин, структурни протеин, повезује саркомеру, сарколему и компоненте ванћелијског матрикса. Рапсин је још један протеин који прихвата АЦхРс и структурне протеине у цитоскелету. Такође је присутан рецептор тирозинске киназе, протеина МуСК, сигнални протеин укључен у развој неуромишићног споја, која се такође одржава у месту при рапсину.[6][7]
Механизам деловања[уреди | уреди извор]
Неуромишићне везе су онде где неурон активира контракцију мишића. По доласку на акциони потенцијал у пресинапсном неуронском терминалу, од напона зависни калцијумови канали се отварају и Ца2+ јони из ванћелијске течности и протичу у пресинапсни неурон у цитосолу. Овај прилив јона Ца2+ узрокује да синапсне везикуле које садрже неуротрансмитер омогуће да и осигурач допусти пролаз кроз ћелијску мембрану пресинапсног неурона путем СНАРЕ протеина. Фузија мехурастих мембрана резултатира у пражњењу пресинапсне ћелијске мембране, односно садржаја везикуле (са ацетилхолином) у синапсну пукотину, у процесу познатом као егзоцитоза. Ацетилхолин дифундира у синапсну пукотину и може се, на моторној плочи, везати за рецепторе никотинског ацетилхолина.
Рецептори ацетилхолина и неуромишићна веза[уреди | уреди извор]

2. Јони
3. Лиганд (ацетилхолин)
Када се лиганд веже за рецептор, јонски канал рецептора се отвара, што омогућава пролаз кроз ћелијску мембрану.
Ацетилхолин је неуротрансмитер који се синтетише из хране, односно холина и ацетил-ЦоА (АЦоА), а учествује у стимулацији мишићног ткива код кичмењака, као и у неких бескичмењака. Код кичмењака, подтип рецептора ацетилхолина који се налази на неуромишићној вези скелетних мишића је рецептор никотинског ацетилколина (нАЦхР), који је лигандом контролисани јонски канал. Свака подјединица овог рецептора има карактеристичну "Цис-петљу", која се састоји од цистеинског остатка у низу од 13 аминокиселинских и других цистеинских остатака. Два цистеинска остатака формирају дисулфидну везу, што резултира у рецептору "Цис-петље" који има способност везивања ацетилколина и других лиганда. Рецептори Цис-петље се могу наћи само код еукариота, мада прокариоте поседују АЦх рецепторе са сличним својствима.
АЦхРс на скелетним неуромишићним везама хетеромерног облика састоје се од две α, једне β, једне ɛ и једне δ подјединице. Када се једнан АЦх лиганд веже за једну од α подјединица АЦХ рецептора, то изазива конформационе промене на граници с другом АЦХР α подјединицама. Ова конформациона промена доводи до повећања афинитета друге α подјединице за други АЦх лиганд. АЦхР рецептори стога испољавају сигмоидну криву дисоцијације услед здруженог везивања. Присуство неактивне, интермедијарне структуре рецептора са једноструко везаним лигандом држи АЦх у синапси који би иначе могао бити изгубљен хидролизом посредство холинестеразе или дифузије. Задржавање ових АЦх лиганда у синапси може да изазове продужени пост-синапсни одговор.
Не делују све неуромишићне везе на бази ацетилхолина; чињеница је да ракови имају глутаматне неуромишићне везе.[8]
Развој неуромишићних веза[уреди | уреди извор]
Развој неуромишићне везе захтева сигнализацију из терминала моторног неурона и из централне регије мишићне ћелије. Током развоја, мишићне ћелије производе рецепторе ацетилхолина (АЦхРс) и испољавају их у централним регијама у процесу који се зове преобразба. Сматра се да агрин, хепарински протеогликан, и МуСК киназа помажу у стабилизацији акумулације АЦХР у централним деловима миоцита. МуСК је рецепторска тирозинска киназа – што значи да покреће ћелијску сигнализацију везивањем молекула фосфата. Након активације својом лигандом агрином, МуСК преноси сигнал помоћу два протеина под називом "Док-7" и "рапсин". Они изазивају груписање рецептора ацетилхолина.[9]
Ослобађањем АЦх у развоју моторних неурона долази до формирања постсинапсног потенцијал у мишићним ћелијама које позитивно ојачавају локализацију и стабилизацију развоја неуромишићне везе.[10][11]
Ови налази су делом демонстрирани на мишевима, путем "трансгенетичких нокаут" истраживања. Мишеви који су дефицитарни за било АГРИН и МуСк, не формирају неуромишићне везе. Надаље, мишеви с Док-7 мањком нису имали ни кластере ацетилхолинских рецептора или неуромишићне синапсе.[12]
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б Хунтер Г. К. : Витал Форцес. Тхе дисцоверy оф тхе молецулар басис оф лифе. Ацадемиц Пресс, Лондон 2000. 2000. ISBN 978-0-12-361811-5.
- ^ Нелсон D. L., Цоx M. M. : Лехнингер Принциплес оф Биоцхемистрy. W. Х. Фрееман анд Цо. 2013. ISBN 978-1-4641-0962-1.
- ^ Халл Ј. Е., Гуyтон А. C. : Теxтбоок оф медицал пхyсиологy, 11тх едитион. Елсевиер Саундерс, Ст. Лоуис, Мо. 2006. ISBN 978-0-7216-0240-0.
- ^ Међедовић С., Маслић Е., Хаџиселимовић Р. : Биологија 2. Свјетлост, Сарајево. 2000. ISBN 978-9958-10-222-6.
- ^ Хаџиселимовић Р., Маслић Е. : Основи етологије – Биологија понашања животиња и људи. Сарајево Публисхинг, Сарајево. 1999. ISBN 978-9958-21-091-4.
- ^ Ницхоллс, Јохн Г.; А. Роберт Мартин; Фуцхс, Паул А.; Броwн, Давид А.; Диамонд, Маттхеw Е.; Wеисблат, Давид А. (2012). Фром Неурон то Браин (5тх изд.). Сундерланд: Синауер Ассоциатес.
- ^ СМ, Сине (2012). „Енд-плате ацетyлцхолине рецептор: струцтуре, мецханисм, пхармацологy, анд дисеасе”. Пхyсиол. Рев. 92 (3): 1189—234. ПМЦ 3489064
 . ПМИД 22811427. дои:10.1152/пхyсрев.00015.2011.
. ПМИД 22811427. дои:10.1152/пхyсрев.00015.2011.
- ^ Сцука M, Мозрзyмас ЈW (1992). „Постсyнаптиц потентиатион анд десенситизатион ат тхе вертебрате енд-плате рецепторс”. Прог. Неуробиол. 38 (1): 19—33. ПМИД 1736323. дои:10.1016/0301-0082(92)90033-Б.
- ^ Валензуела D, Ститт Т, ДиСтефано П, Ројас Е, Маттссон К, Цомптон D, Нуñез L, Парк Ј, Старк Ј, Гиес D (1995). „Рецептор тyросине синасе специфиц фор тхе скелетал мусцле линеаге: еxпрессион ин ембрyониц мусцле, ат тхе неуромусцулар јунцтион, анд афтер ињурy”. Неурон. 15 (3): 573—84. ПМИД 7546737. дои:10.1016/0896-6273(95)90146-9.
- ^ Гласс D, Боwен D, Ститт Т, Радзиејеwски C, Бруно Ј, Рyан Т, Гиес D, Схах С, Маттссон К, Бурден С, ДиСтефано П, Валензуела D, ДеЦхиара Т, Yанцопоулос Г (1996). „Агрин ацтс виа а МуСК рецептор цомплеx”. Целл. 85 (4): 513—23. ПМИД 8653787. дои:10.1016/С0092-8674(00)81252-0.
- ^ V, Wитземанн (2006). „Девелопмент оф тхе неуромусцулар јунцтион”. Целл Тиссуе Рес. 326 (2): 263—71. ПМИД 16819627. дои:10.1007/с00441-006-0237-x.
- ^ Окада К, Иноуе А, Окада M, Мурата Y, Какута С, Јигами Т, Кубо С, Схираисхи Х, Егуцхи К, Мотомура M, Акиyама Т, Иwакура Y, Хигуцхи О, Yаманасхи Y (2006). „Тхе мусцле протеин Док-7 ис ессентиал фор неуромусцулар сyнаптогенесис”. Сциенце. 312 (5781): 1802—5. ПМИД 16794080. дои:10.1126/сциенце.1127142.
Литература[уреди | уреди извор]
- Кандел, ЕР; ЈХ, Сцхwартз; Јесселл ТМ. (2000). Принциплес оф Неурал Сциенце (4тх изд.). Неw Yорк: МцГраw-Хилл. ИСБН 978-0-8385-7701-1.
- Ницхоллс, Ј.Г.; А.Р. Мартин; Б.Г. Wаллаце; П.А. Фуцхс (2001). Фром Неурон то Браин (4тх изд.). Сундерланд, МА.: Синауер Ассоциатес. ИСБН 978-0-87893-439-3.
- Енгел, А.Г. (2004). Мyологy (3рд изд.). Неw Yорк: МцГраw Хилл Профессионал. ИСБН 978-0-07-137180-3.
Спољашње везе[уреди | уреди извор]
- Boston University Histology Learning System: 21501lca
