Аминокиселина
Аминокиселине су једињења која садрже амино групу (-NH2) и карбоксилну групу (-COOH).[1] У састав аминокиселина улазе следећи елементи: C, H, N и O. Аминокиселине изграђују протеине и учествују у метаболичким процесима. Аминокиселине чине 20% свих органских молекула који изграђују ћелије, ткива и органе. У природи постоји више од петсто аминокиселина, али се протеини свих врста, од бактерија до људи, првенствено састоје од само њих двадесет.[2] Одрастао човек може синтетисати све изузев девет аминокиселина. Ових девет се зову есенцијалне аминокиселине, због тога што се морају уносити храном. Енормна структура и функционална сложеност протеина произилази из различитих комбинација ових аминокиселина које се везују у полимере и асоцијате са различитим непротеинским супстанцама.[3][4][5]
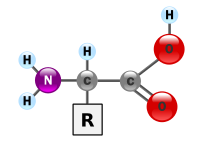
Све аминокиселине које граде протеине су α-аминокиселине пошто су амино и карбоксилне групе везане за исти, α-атом угљеника. Поред амино и карбоксилне групе, структуру аминокиселина одређује и бочни ланац који се назива и остатак и обележава се са R. R-групе садрже карактеристичне особине појединих аминокиселина, и могу их чинити алифатични или ароматични бочни ланци који могу садржати друге реактивне групе, могу бити више или мање поларне, хидрофилне или хидрофобне итд.
Структура и својства аминокиселина[уреди | уреди извор]
Амино и карбоксилна група у молекулу аминокиселина везане су за исти атом, α-атом угљеника, према томе то су α-аминокиселине и могу се приказати следећом општом формулом. R група представља бочни низ, а то могу бити алкил или поларне групе. Посебан случај је аминоетанска киселина (глицин, CH2-COOH) чији бочни ланац је водоник.
Код свих аминокиселина које улазе у састав протеина, сем једне (глицин), алфа угљеников атом је асиметричан (хиралан) те се стога могу наћи у облику два енантиомера. Све аминокиселине које синтетише хумани организам имају релативну L-конфигурацију. Постоје аминокиселине које имају два хирална центра (изолеуцин и треонин), што значи да имају по два пара енантиомера.
Аминокиселине које су познате одавно, углавном имају тривијална имена која су добиле према биљним или животињским ткивима у којима су првобитно пронађени (глутамин према пшеничном брашну глутену, тирозин према грчкој речи за сир итд.). Аминокиселине имају хемијске називе који се формирају као деривати киселина у којима је супституција извршена са тачном ознаком положаја бочног ланца и супституента.
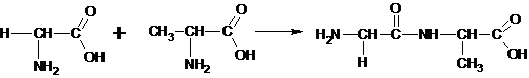
Најважнија хемијска реакција аминокиселина је формирање пептидне везе која омогућава повезивање две аминокиселине и стварање ланца аминокиселина (пептида и протеина). Пептидна веза је веза између карбоксилне групе једне аминокиселине и амино групе друге аминокиселине, у којој се атом угљеника карбоксилне групе везује за атом азота уз ослобађање молекула воде. У формирању молекула воде учествују -OH из карбоксилне групе и водоник из амино групе.
Подела[уреди | уреди извор]
Разликују се две групе аминокиселина: једна група су оне чија је функција да изграђују протеине и учествују у метаболичким процесима - протеиногене, а друга група су оне које учествују само у метаболичким процесима - непротеиногене.
Према природи R-групе, аминокиселине које граде протеине се могу класификовати у седам група:
- Аминокиселине са неполарним (хидрофобним) бочним низом: аланин, валин, леуцин, изолеуцин, глицин и пролин;
- Аминокиселине са ароматичним бочним низом: фенилаланин, тирозин и триптофан;
- Аминокиселине са базним бочним низом: лизин, аргинин и хистидин;
- Аминокиселине са киселинским остатком у бочном низу: аспарагинска киселина и глутаминска киселина;
- Аминокиселине са амидним остатком у бочном низу: аспарагин и глутамин;
- Аминокиселине са хидроксилном групом у бочном низу: серин и треонин;
- Аминокиселине са сумпором у бочном низу: метионин и цистеин
"Стандардне" аминокиселине и њихова својства[уреди | уреди извор]
| Аминокисела | Три слова[6] | Једно слово[6] | Поларност бочног ланца[6] | pH бочног ланца (pH 7,4)[6] | Хидропатски индекс[7] | Апсорбанција λmax(nm)[8] | ε при λmax (mM−1 cm−1)[8] | MW (Молекулска маса)[9] |
|---|---|---|---|---|---|---|---|---|
| Аланин | Ala | A | Неполарно | Неутрално | 1.8 | 89 | ||
| Аргинин | Arg | R | Базно поларно | Позитиван | −4.5 | 174 | ||
| Asparagin | Asn | N | Поларно | Неутрално | −3.5 | 132 | ||
| Аспарагинска киселина | Asp | D | Кисело поларно | Негативно | −3.5 | 133 | ||
| Цистеин | Cys | C | Неполарно | Неутрално | 2.5 | 250 | 0.3 | 121 |
| Глутаминска киселина | Glu | E | Кисело поларно | Негативно | −3.5 | 147 | ||
| Глутамин | Gln | Q | Поларно | Неутрално | −3.5 | 146 | ||
| Глицин | Gly | G | Неполарно | Неутрално | −0.4 | 75 | ||
| Хистидин | His | H | Базно поларно | Позитивно (10%)
Неутрално (90%) |
−3.2 | 211 | 5.9 | 155 |
| Изолеуцин | Ile | I | Неполарно | Неутрално | 4.5 | 131 | ||
| Леуцин | Leu | L | Неполарно | Неутрално | 3.8 | 131 | ||
| Лизин | Lys | K | Базно поларно | Позитивно | −3.9 | 146 | ||
| Метионин | Met | M | Неполарно | Неутрално | 1.9 | 149 | ||
| Фенилаланин | Phe | F | Неполарно | Неутрално | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165 |
| Пролин | Pro | P | Неполарно | Неутрално | −1.6 | 115 | ||
| Серин | Ser | S | Поларно | Неутрално | −0.8 | 105 | ||
| Треонин | Thr | T | Поларно | Неутрално | −0.7 | 119 | ||
| Триптофан | Trp | W | Неполарно | Неутрално | −0.9 | 280, 219 | 5.6, 47.0 | 204 |
| Тирозин | Tyr | Y | Поларно | Неутрално | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181 |
| Валин | Val | V | Неполарно | Неутрално | 4.2 | 117 |
Две додатне аминокиселине код неких врста су кодиране кодонима који се обично интерпретирају као стоп кодони:
| 21. и 22. аминокиселина | Три слова | Једно слово |
|---|---|---|
| Селеноцистеин | Sec | U |
| Пиролизин | Pyl | O |
Поред специфичних кодова за аминокиселине, држачи њихових места користе се у случајевима у којима се протеини секвенцирају хемијски или за кристалографске анализе пептида или протеина не може коначно детерминисати идентитет остатака.
| Двосмислена аминокиселина | Три слова | Једно слово |
|---|---|---|
| Аспарагин или аспартинска киселина | Asx | B |
| Глутамин или глутаминска киселина | Glx | Z |
| Леуцин или Изолеуцин | Xle | J |
| Неспецифична или непозната аминокиселина | Xaa | X |
Unk је понекад уместо Xaa, али је мање стандардно. Осим тога, многе нестандардне аминокиселине имају специфични код. На примјер, неколико пептидних дрога (лијекова), као што су Бортезомиб и МГ132, су умјетно синтетизирани и задржавали своје заштићујуће групе које имају специфичне кодова. Бортезомиб је Pyz - Phe-boroLeu, а MG132 је карбоксибензил Z-Leu-Leu-Leu-al. За помоћ у анализи структуре протеина, расположиве су фото-реактивне аналогне аминокиселине. То укључује фотолеуцин (pLeu) и фотометионин (pMet).[10]
Најважнија хемијска реакција аминокиселина је формирање пептидне везе која омогућава повезивање две аминокиселине и стварање ланца аминокиселина (пептиди и протеини). Пептидна веза је веза између карбоксилне групе једне аминокиселине и амино групе друге аминокиселине, у којој се атом угљеника везује за атом азота уз ослобађање молекула воде.
У састав човековог организма улази укупно 20 аминокиселина. 10 од њих могу да се изграде у самом организму, док је преосталих 10 неопходно унети кроз исхрану. Аминокиселине које човеков организам није у стању да направи, а неопходне су за његово функционисање се називају есенцијалним аминокиселинама.
Структурне формуле "стандардних" аминокиселина[уреди | уреди извор]
-
L-аланин (Ala / A)
-
L-аргинин (Arg / R)
-
L-аспарагин (Asn / N)
-
L-аспарагинска киселина (Asp / D)
-
L-цистеин (Cys / C)
-
L-глутаминска киселина (Glu / E)
-
L-глутамин (Gln / Q)
-
L-глицин (Gly / G)
-
L-хистидин (His / H)
-
L-изолеуцин (Ile / I)
-
L-леуцин (Leu / L)
-
L-лизин (Lys / K)
-
L-метионин (Met / M)
-
L-фенилаланин (Phe / F)
-
L-пролин (Pro / P)
-
L-серин (Ser / S)
-
L-треонин (Thr / T)
-
L-триптофан (Trp / W)
-
L-тирозин (Tyr / Y)
-
L-валин (Val / V)
Синтеза аминокиселина[уреди | уреди извор]
Биосинтеза аминокиселина[уреди | уреди извор]
Нормална исхрана обезбеђује већину аминокиселина потребних за биосинтезу протеина и за продукцију азотних једињења мале молекулске масе. Одржавање неопходне резерве аминокиселина у нашем организму омогућено је уносом хране, разградњом телесних протеина и биосинтезом неесенцијалних аминокиселина. Управо биосинтеза неесенцијалних аминокиселина највише варира у организму и кључна је у регулацији равнотеже. Процеси биосинтезе аминокиселина међусобно се разликују тако да постоји двадесет различитих анабиотичких процеса. У нашим ћелијама присутни су сви потребни ензими за синтезу отприлике половине аминокиселина, које чине групу неесенцијалних аминокиселина. Есенцијалне аминокиселине се морају уносити храном јер наш организам не садржи потребне ензиме за њихову синтезу.
Већина аминокиселина се могу синтетисати у довољним количинама од неког уобичајеног интермедијера метаболизма или од есенцијалних аминокиселина. Синтеза аминокиселина се одвија обично од одговарајуће кето киселине реакцијом трансаминације и генерално глутамат је донор амино - групе. Процеси биосинтезе неесенцијалних аминокиселина су једноставни и укључују мали број ензима, углавном један. За разлику од ових процеса, биосинтеза есенцијалних аминокиселина је знатно компликованија и укључује велики број ензима.
Хемијска синтеза аминокиселина[уреди | уреди извор]
- Хел-Волхард-Зелинскијева реакција
Ово је реакција бромовања карбоксилне киселине на α-угљениковом атому. Даље, бром се у производу може заменити нуклеофилом као што је амонијак.
- Штрекерова синтеза
Ова реакција се изводи у присуству амонијака и цијанхидрина. Полазни реагенс у овој синтези је одређени алдехид, у зависности коју аминокиселину желимо добити. На интермедијерни имин се адира цијанхидрин и добијају се одређени α-аминонитрили. Даљом киселом или базном хидролизом се добијају α-аминокиселине.
Реакције аминокиселина[уреди | уреди извор]
Реакција настајања пептида[уреди | уреди извор]
Аминокиселине садрже слободну амино и карбоксилну групу и због тога имају способност да дају све реакције карактеристичне за ове две групе. Код неких аминокиселина реагују и карактеристичне функционалне групе у бочном низу.
Слободна карбоксилна група учествује и органским реакцијама које дају амиде, естре или анхидриде. од свих су најзначајније реакције настајања амида, несупституисани (са амонијаком) или супституисани амиди (са другим аминима) који се називају пептиди.
Реакција аминокиселина са хлоридима органских киселина[уреди | уреди извор]
Амино група у аминокиселинама која је слободна и може да реагује са хлоридима киселина, односно, може се ациловатии, при чему губи своје базне особине. Важна реакција α-амино групе је реакција са угљен-диоксидом при чему настају карбамино киселине које код човека представљају један од начина преноса угљен-диоксида из ткива у плућа.
Деградација аминокиселина[уреди | уреди извор]
Кључни процес у деградацији аминокиселина је трансаминација у којој α-аминокиселина реагује са α-кетокиселином при чему кето и амино група мењају места. Пример за то је Кребсов циклус у коме се појављује α-кетоглутарна киселина. Ова киселина у реакцији са амонијаком даје глутаминску киселину. Добијена глутаминска киселина у реакцији са другим α-кетокиселинама као производ даје одређену α-кетокиселину и одређену аминокиселину. У организму велики број аминокиселина настаје на овај начин.
Аминокиселине као трансмитери[уреди | уреди извор]
Важно место међу неуротрансмитерима у централном нервном систему заузимају аминокиселине и то:
L-глутамат је главни ексцитаторни трансмитер који је присутан у свим деловима централног нервног система. Шездесетих година 20. века сматрало се да ГАБА и екцитаторне аминокиселине (ЕАА) нису ништа друго него фармаколошки куриозитети. Током седамдесетих установљено је да је најпростија аминокиселина глицин инхибиторни трансмитер у кичменој мождини, што је поставило основе за идеју да трансмитери морају да буду необични молекули, чија је најбитнија улога да се вежу за рецепторе. Највећи напредак учињен је открићем ЕАА антагониста, који је омогућио да физиолошка улога глутамата буде недвосмислено потврђена што је допринело и спознаји хетерогене природе ЕАА рецептора.
Метаболизам и ослобађање аминокиселина[уреди | уреди извор]
Глутамат је широко и равномерно распоређен у ЦНС-у где је његова концентрација много виша него у другим ткивима. Он има важну метаболичку улогу, при чему су метаболички и депои трансмитера повезани преко ензима трансаминаза који катализују интерконверзију глутамата и α-кетоглутарата. Глутамат у ЦНС-у потиче углавном из глукозе, преко циклуса трикарбоксилних киселина (Кребсов циклус), или из глутамина, кога синтетишу ћелије глије, а преузимају неурони. Међусобна повезаност путева синтезе ЕАА и инхибиторних аминокиселина (ГАБА и глицина), отежава коришћење трансмитера у експерименталним процедурама с циљем истраживања функционалних улога појединих аминокиселина, јер би поремећаји на било ком од корака у њиховој синтези утицали на екцитаторне и инхибиторне медијаторе.
Као и код осталих неуротрансмитера, депои глутамата налазе се у синаптичким везикулама из којих се ослобађа помоћу калцијум-зависне егзоцитозе специфични транспортерски протеини омогућавају њихово преузимање у неуроне и друге ћелије, као и њихово накупљање у синаптичким везикулама. Дејство глутамата углавном се прекида поновним преузимањем у нервне завршетке и суседне астроците преко носача. Овај транспорт може, под извесним околностима функционисати и у супротном правцу и тако постати извор ослобађања глутамата. Глутамат који преузму астроцити претвара се у глутамин и браћа се преко носача назад у неуроне, где опет долази до конверзије глутамина у глутамат.
Референце[уреди | уреди извор]
- ^ Мишић, Милан, ур. (2005). Енциклопедија Британика. А-Б. Београд: Народна књига : Политика. стр. 43. ISBN 86-331-2075-5.
- ^ Introducing Amino Acids. chemguide.co.uk
- ^ „Amino acids”. Peptides from A to Z: A Concise Encyclopedia. John Wiley & Sons. 2008. стр. 20. ISBN 978-3-527-62117-0.
- ^ Pollegioni, Loredano; Servi, Stefano, ур. (2012). Unnatural Amino Acids. Humana Press. стр. v. ISBN 978-1-61779-331-8.
- ^ Hertweck 2011, стр. 9540–9541.
- ^ а б в г Hausman & Cooper 2004
- ^ Kyte J, Doolittle RF (мај 1982). „A simple method for displaying the hydropathic character of a protein”. Journal of Molecular Biology. 157 (1): 105—32. PMID 7108955. doi:10.1016/0022-2836(82)90515-0.
- ^ а б Freifelder, D. (1983). Physical Biochemistry (2nd изд.). W. H. Freeman and Company. ISBN 978-0-7167-1315-9.
- ^ „Архивирана копија”. Архивирано из оригинала 30. 5. 2016. г. Приступљено 25. 12. 2018.
- ^ Suchanek M, Radzikowska A, Thiele C (1. 4. 2005). „Foto-leucin i foto-metionina omogućavaju identifikaciju interakcija protein-protein u živim ćelijama”. Nature Methods. 2 (4): 261—7. PMID 15782218. doi:10.1038/nmeth752.
Литература[уреди | уреди извор]
- Мишић, Милан, ур. (2005). Енциклопедија Британика. А-Б. Београд: Народна књига : Политика. стр. 43. ISBN 86-331-2075-5.
- Hausman RE, Cooper GM (2004). The cell: a molecular approach. Washington, D.C: ASM Press. стр. 51. ISBN 978-0-87893-214-6.
- Pollegioni, Loredano; Servi, Stefano, ур. (2012). Unnatural Amino Acids. Humana Press. стр. v. ISBN 978-1-61779-331-8.
- Doolittle, Russell F. (1989). „Redundancies in protein sequences”. Ур.: Fasman, G. D. Predictions of Protein Structure and the Principles of Protein Conformation. New York
- Tymoczko, John L. (2012). „Protein Composition and Structure”. Biochemistry. New York: W. H. Freeman and company. стр. 28-31. ISBN 978-1-4292-2936-4.: Plenum Press. стр. 599-623. ISBN 978-0-306-43131-9. LCCN 89008555. line feed character у
|location=на позицији 9 (помоћ) - Guyton, AC; Hall, JE (2005). Textbook of Medical Physiology. Elsevier Science - IE.
- Meierhenrich, Uwe (2008). Amino acids and the asymmetry of life (PDF). Berlin: Springer Verlag. ISBN 978-3-540-76885-2. LCCN 2008930865. Архивирано из оригинала 12. 01. 2012. г. Приступљено 20. 06. 2017.
- Morelli, Robert J. (1952). Studies of amino acid absorption from the small intestine. San Francisco.
- Nelson, David L.; Cox, Michael M. (2000). Lehninger Principles of Biochemistry (3rd изд.). Worth Publishers. ISBN 978-1-57259-153-0. LCCN 99049137.
- K. Peter C., Vollhardt; Schore, Neil (1997). Органска хемија. Београд.
Чланци[уреди | уреди извор]
- Hertweck, Christian (2011). „Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid”. Angew. Chem. Int. Ed. 50: 9540—9541. doi:10.1002/anie.201103769.