Хиперурикемија
| Хиперурикемија | |
|---|---|
 | |
| Кристали мокраћне киселине |
Хиперурикемија или урикемија је повећан ниво мокраћне киселине (МК) у крви, које може довести до појаве гихта.
Општи појмови
[уреди | уреди извор]Хиперурикемија се дефинише као серумска концентрација МК >360 µmol/l или >6,8mg/dL.[1]
При pH вредности крви 7,4 праг растворљивости мокраћне киселине је концентрација ≥ 408 µmol/l.
Кристализацију мокраћне киселине провоцирају смањење киселости ткива, дехидратација, повреда и нагли губитак телесне масе (мршављење).
Епидемиологија
[уреди | уреди извор]Хиперурикемија је веома честа у општој популацији и креће се на глобалном нивоу до 20%. Честа је код мушкараца и жена у менопаузи.[2] Мушкарци обољевају 3-4 пута чешће што се објашњава урикозуричким ефектом естрогена.[3]
Годишња инциденција гихта као последица хиперурикемије је различита код особа са различитим степеном хиперурикемије. Уколико је серумска концентрација мокраћне киселине (МК) ≥ 500 µmol/l преваленција је око 5%.[4]
Последњих деценија преваленција и инциденција хиперурикемије је у порасту. Објашњење треба тражити у:[5]
- променама животних навика и навика у исхрани,
- порасту особа са метаболичким синдромом,
- све чешћој примени диуретика, β блокатора и малих доза аспирина.
Преваленција хиперурикемије је до 2% код нормално ухрањених а код гојазних особа чак 5%.[6]
Етиопатогенеза
[уреди | уреди извор]Упркос чињеници да је мокраћна киселина први пут идентификована пре отприлике 2 века, одређени патофизиолошки аспекти хиперурикемије још увек нису јасно схваћени. Годинама је хиперурикемија идентификована или се сматрала да је иста као гихт, али је мокраћна киселина сада идентификована као маркер за бројне метаболичке и хемодинамске абнормалности.[7][8]
Као могући узроци хиперурикемије наводе се: хиперурикемија због смањеног или недоовољног излучивања (хипосекреција мокраћне киселине), повећане производње (хиперепродукције мокраћне киселине) или комбинације ова два механизма.
Хипосекреција мокраћне киселине
[уреди | уреди извор]Хипосекрецију мокраћне киселине (која се јавња у 90% случајева), изазвају:
- болести бубрега
- лекови (аспирин, диуретици, етамбутол, пиразинамид, циклоспорин, β-блокатори)
Недовољно излучивање мокраћне киселине чини већину узрока хиперурикемије, последица је поремећаја у промету урата у бубрезима који укључује филтрацију у гломерулу, реапсорпцију, секрецију и, коначно, постсекреторну реапсорпцију. Сходно томе, измењено излучивање мокраћне киселине може бити последица смањене гломеруларне филтрације, смањене тубуларне секреције или појачане тубуларне реапсорпције. Органске киселине које се акумулирају у овим условима такмиче се са уратима за тубуларну секрецију. Коначно, појачана реапсорпција мокраћне киселине дистално од места секреције је механизам за који се сматра да је одговоран за хиперурикемију уочену диуретичком терапијом и дијабетесом инсипидусом.[9]
Хиперепродукција мокраћне киселине
[уреди | уреди извор]Хиперепродукцију мокраћне киселине (која се јавња у 90% случајева) изазвају:[9]
- дефицит хипоксантин гванозин фосфорибозил трансферазе а хиперактивност фосфорибозил пирофосфат синтетазе
- деструкција ћелија у току лечења мијело и лимфопролиферативних болести
- цитотоксичним лековим (варфарин, витамин Б12)
- полицитемија вера,
- хемолитичка болест,
- псоријаза,
- дијета богата пуринима,
- конзумирање алкохола
Док смањена филтрација урата можда не изазива примарну хиперурикемију, може допринети хиперурикемији бубрежне инсуфицијенције. Смањена тубуларна секреција урата јавља се код пацијената са ацидозом (нпр. дијабетичка кетоацидоза, интоксикација етанолом или салицилатом, кетоза гладовања). Органске киселине које се акумулирају у овим условима такмиче се са уратима за тубуларну секрецију. Коначно, појачана реапсорпција мокраћне киселине дистално од места секреције је механизам за који се сматра да је одговоран за хиперурикемију уочену диуретичком терапијом и дијабетесом инсипидусом.
Комбиновани механизми
[уреди | уреди извор]Комбиновани механизми (недовољно излучивање и прекомерна производња) такође могу изазвати хиперурикемију. Најчешћи узрок у овој групи је конзумација алкохола, што резултује убрзаним разградњом АТП-а у јетри и стварањем органских киселина које се такмиче са уратима за тубуларну секрецију.[10]
Ензимски дефекти као што су гликогенозе типа 1 и недостатак алдолазе-Б су други узроци хиперурикемије који су резултат комбинације прекомерне производње и недовољног излучивања.[9]
Клиничка слика
[уреди | уреди извор]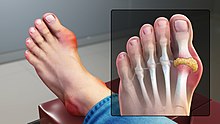
Осим ако високи нивои мокраћне киселине у крви не изазивају симптоме, случајним прегледом у клиничкој лабораторији открива се хиперурикемија код већине људи без клиничке слике,[11] јер не развијају сви људи са хиперурикемијом гихт или нефролитијазу.
Развој гихта – који је болан, краткотрајан поремећај – најчешћа је последица хиперурикемије, која узрокује таложење кристала мокраћне киселине обично у зглобовима екстремитета, али такође може изазвати стварање камена у бубрегу, још једног болног поремећаја.[12]
Симптоми гихта су типично запаљење, оток и црвенило зглоба, као што је прст на нози или колено, праћени интензивним болом.[13]
Пацијенти са хроничним гихтним артритисом могу развити тофус у хеликсу или антихеликсу уха, дуж улнарне површине подлактице, у бурзи олекранона или у другим ткивима.
Код нефролитијазе изазване мокраћном киселином, пацијенти могу имати бол у трбуху или слабинама.
Дијагноза
[уреди | уреди извор]Код пацијената са хиперурикемијом, на основу узете историја болести одређује се да ли је пацијент симптоматски или асимптоматски и утврђује етиологија и коморбидно стање.
Симптоми су гихт и нефролитијаза, са следћим дијагностичким знацима:[14]
- Гихт се обично манифестује као акутни моноартритис, најчешће у великом прсту ноге, а ређе у тарзалном зглобу, колену и другим зглобовима.
- Нефролитијаза извана мокраћном киселином која семанифестује као хематурија; бол у слабинама, трбуху или ингвиналној регији и/или мучнина и повраћање.
Диференцијална дијагноза[15]
[уреди | уреди извор]- алкохолна кетоацидоза
- дијабетесна кетоацидоза (ДКА)
- гихт и псеудогут
- хемолитичка анемија
- Ходџкинов лимфом
- хиперпаратироидизам и хипотиреоза
- нефролитијаза
- прееклампсија (токсемија трудноће)
- тип 1а болести складиштења гликогена
- нефропатија мокраћне киселине.[15]
Терапија
[уреди | уреди извор]Хигијенско-дијететски режим
[уреди | уреди извор]Крајњи циљ лечења је елиминација депозита кристала мокраћне киселине. То се може постићи само ако је концентрација МК у серуму <360 umol/l.[16][17][18][19] При овим концентрацијама ризик од појаве акутног артритиса и годишња учесталост напада се своде на минимум.
Први корак у регулисању хиперурикемије је промена животних навика и придржавање дијететском режиму. Саветује се исхарана сиромашна пуринима и фруктозом. Гојазни треба да смање телесну масу. Саветује се редовно физичко вежбање, престанак пушења и адекватна хидратација. У односу на садржај пурина намирнице које се користе у исхрани код хиперурикемије категоризоване су у забрањене, ограничене и оне које се препоручују (види табелу).
| Препоручене | Ограничене | Забрањене |
|---|---|---|
| јаја | шпаргла | инћуни |
| ораси, кикирики бутер | карфиол | сардине |
| сиреви са мало масти | спанаћ | скуша |
| обрано или 1% млеко | махунасто поврће | туна |
| супе и чорбе без меса | кувани парадајз | харинга |
| поврће | кромпир | бакалар |
| воће и воћни сокови | пилетина | шкољке |
| бели хлеб, пециво, двопек | овчије месо | дивљач |
| пшеничне клице | печурке | изнутрице |
| пасте | овас и овсена каша | сосови са месом |
| пиринач | пшеничне клице и мекиње | месне прерађевине |
| корнфлекс | интегрално брашно | сланина |
| кокице | хлеб од ражи | свињско месо |
| кукурузно брашно | шећер | говеђе месо |
| ћуреће бело месо | мед | сочиво |
| јагњеће месо | чоколада | пуномасно млеко и сиреви |
| вода | маст | квасац |
Употребу алкохолних пића треба свести на минимум. Препорука се нарочито односи на пиво. Горња дозвољена граница алкохола је 4 јединице за мушкарце а 3 за жене. Алкохолна јединица је однос јачине и количине алкохолног пића
Веома је важно да болесници узимају 1—1,5 l воде у току дана. Адекватном хидратацијом се поспешује гломерулска филтрација и смањује могућност кристализације мокраћне киселине у тубулима. Уносом течности се одржава адекватна количина синовијске течности и тако спречава кристализација мокраћне киселине у зглобу.
Забрањена је употреба сокова богатих фруктозом
Препоручују се намирнице сиромашне мастима.
Препоручује се исхрана богата воћем и поврћем.
Терапија лековима
[уреди | уреди извор]Како дијета и промена животних навика у већини случајева нису довољни да одржавају нормалну урикемију (јер смањују урикемију за 10–18%), индикована је фармакотерапија код болесника који имају један или више тофуса, најмање два атака артритиса годишње, хроничну бубрежну инсуфицијенцију другог степена и/или уролитијазу.
Код болесника са бубрежном инсуфицијенцијом дозе лекова треба прилагодити клиренсу креатинина.
Болесници који појачано стварају мокраћну киселину треба да узимају инхибиторе ксантин оксидазе.
Код болесника са нормалним клиренсом креатинина који имају смањену екскрецију МК индикована је примена урикозурика. Лекови првог избора за нормализовање концентрације МК у серуму су инхибитори ксантин оксидазе.
У случају контраиндикација или интолеранције алтернатива инхибиторима ксантин оксидазе су урикозурици.
Терапија хипоурицима се може започети и у акутном нападу под условом да је обезбеђена адекватна антиинфламаторна терапија.[21][22]
Урикемију треба контролисати на 2—5 седмица док се доза лека не подеси. Када се постигне задовољавајућа урикемија контроле су на 6 месеци. Редовним контролама се поуздано прати и приврженост терапији.[23][24] Концентрација МК у серуму треба да буде < 360 µmo/l код свих болесника. За ублажавање клиничке слике гихта концентрација МК треба да буде <300 µmol/l.
Компликације
[уреди | уреди извор]Хиперурикемија може довести до обољења претходно здравих бубрега.
- Акутна уратна нефропатија настаје због опструкције тубула кристалима мокраћне киселине. Обично се дешава код болесника са леукемијом и лимфомом.
- Код болесника са хроничном хиперурикемијом у интерстицујуму бубрега може доћи до стварања микротофа који изазивају хронично запаљење. Хронично запаљење временом доводи до фиброзе и инсуфицијенције бубрега. Интерстицијалне и гломерулске промена могу настати и без кристализације. Промене су сличне онима у дуготрајној артеријској хипертензији.
- Код болесника који имају хроничну појачану екскрецију мокраћне киселине, нарочито када је киселост урина снижена, могу се створити уратни кеменци. Они чине 5-10% свих бубрежних каменаца.
Види још
[уреди | уреди извор]Извори
[уреди | уреди извор]- ^ George C, Minter DA. Hyperuricemia. 2022 Jan.
- ^ Bhole V, de Vera M, Rahman MM, Krishnan E, Choi H (2010). „Epidemiology of gout in women: fifty-two–year followup of a prospective cohort.”. Arthritis Rheum. 62: 1069—76..
- ^ WEAVER, A. L. (2008-07-01). „Epidemiology of gout”. Cleveland Clinic Journal of Medicine. 75 (Suppl_5): S9—S12. ISSN 0891-1150. doi:10.3949/ccjm.75.suppl_5.s9.
- ^ Riedel, Aylin Altan; Nelson, Mike; Wallace, Katrine; Joseph-Ridge, Nancy; Cleary, Michele; Fam, Adel G. (2004). „Prevalence of Comorbid Conditions and Prescription Medication Use Among Patients With Gout and Hyperuricemia in a Managed Care Setting”. JCR: Journal of Clinical Rheumatology. 10 (6): 308—314. ISSN 1076-1608. doi:10.1097/01.rhu.0000147049.12220.32.
- ^ Lin K C, Lin H Y, Chou P (2000). „Community based epidemiological study on hyperuricemia and gout in Kin‐Hu, Kinmen”. J Rheumatol. 27: 1045—50..
- ^ Brook RA, Forsythe A, Smeeding JE, Lawrence EN (2010). „Chronic gout: epidemiology, disease progression, treatment and disease burden”. Curr Med Res Opin. 26: 2813—21..
- ^ Stack A, Manolis AJ, Ritz E (септембар 2015). „Detrimental role of hyperuricemia on the cardio-reno-vascular system”. Curr Med Res Opin. 31 (Suppl 2): 21—6..
- ^ Johnson RJ, Kivlighn SD, Kim YG, Suga S, Fogo AB (фебруар 1999). „Reappraisal of the pathogenesis and consequences of hyperuricemia in hypertension, cardiovascular disease, and renal disease”. Am J Kidney Dis. 33 (2): 225—34..
- ^ а б в „Hyperuricemia: Practice Essentials, Pathophysiology, Etiology”. emedicine.medscape.com. 2023-06-30.
- ^ Shiraishi, Hiroshi; Une, Hiroshi (2009). „The Effect of the Interaction between Obesity and Drinking on Hyperuricemia in Japanese Male Office Workers”. Journal of Epidemiology. 19 (1): 12—16. ISSN 1349-9092. doi:10.2188/jea.je20080016.
- ^ Singh, Jasvinder A; Reddy, Supriya G; Kundukulam, Joseph (2011). „Risk factors for gout and prevention: a systematic review of the literature”. Current Opinion in Rheumatology. 23 (2): 192—202. ISSN 1040-8711. doi:10.1097/bor.0b013e3283438e13.
- ^ Perez‐Ruiz, Fernando; Hernandez‐Baldizon, Samuel; Herrero‐Beites, Ana M.; Gonzalez‐Gay, Miguel A. (2010). „Risk factors associated with renal lithiasis during uricosuric treatment of hyperuricemia in patients with Gout”. Arthritis Care & Research. 62 (9): 1299—1305. ISSN 2151-464X. doi:10.1002/acr.20221.
- ^ LOGAN, J A; MORRISON, E; McGILL, P E (1997-11-01). „Serum uric acid in acute gout”. Annals of the Rheumatic Diseases. 56 (11): 696—697. ISSN 0003-4967. doi:10.1136/ard.56.11.696a.
- ^ „Hyperuricemia Clinical Presentation: History, Physical Examination”. emedicine.medscape.com. Приступљено 2023-11-20.
- ^ а б „Hyperuricemia Differential Diagnoses”. emedicine.medscape.com. Приступљено 2023-11-20.
- ^ Schumacher HR Jr, Chen LX. The practical management of gout. Cleve Clin J Med. 2008;75(suppl 5):S22-S25.
- ^ Terkeltaub R (2010). „Update on gout: new therapeutic strategies and options”. Nat Rev Rheumatol. 6: 30—8..
- ^ Eggebeen AT (2007). „Gout: an update”. American Family Physician. 76: 801—8..
- ^ Choi HK (2010). „A prescription for lifestyle change in patients with hyperuricemia and gout”. Current Opinion in Rheumatology. 22: 165—72.
- ^ Weaver AL, Cheh MA, Kennison RH. How PCP education can impact gout management: the gout essentials. J Clin Rheumatol. 2008;14(suppl):S42-S46.
- ^ Taylor, Thomas H.; Mecchella, John N.; Larson, Robin J.; Kerin, Kevin D.; MacKenzie, Todd A. (2012). „Initiation of allopurinol at first medical contact for acute attacks of gout: A randomized clinical trial”. The American Journal of Medicine. 125 (11): 1126—34. PMID 23098865. doi:10.1016/j.amjmed.2012.05.025..
- ^ Wortmann RL, Macdonald PA, Hunt B, Jackson RL (2010). „Effect of prophylaxis on gout flares after the initiation of uratelowering therapy: analysis of data from three phase III trials”. Clin Ther. 32 (14): 2386—97. PMID 21353107. doi:10.1016/j.clinthera.2011.01.008..
- ^ Radak-Perović M, Zlatković-Svenda M.Quality of treatment in gouty patients considering EULAR recommendations.Srp Arh Celok Lek. 140 717–21.
- ^ Rees, Frances; Jenkins, Wendy; Doherty, M. (2013). „Patients with gout adhere to curative treatment if informed appropriately: Proof-of-concept observational study”. Ann Rheum Dis. 72 (6): 826—30. PMID 22679303. doi:10.1136/annrheumdis-2012-201676..
Спољашње везе
[уреди | уреди извор]| Класификација | |
|---|---|
| Спољашњи ресурси |
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
