Алил
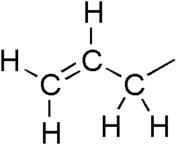

Алил група је супституент са структурном формулом H2C=CH-CH2R, где је R остатак молекула. Она се састоји од метилена (-CH2-) везаног за винил групу (-CH=CH2).[1][2] Име је изведено из латинске речи за бели лук, Allium sativum. Први алилни дериват је изолован из уља белог лука 1844.[3][4] Термин алил се односи на мноштво једињења која су сродна са H2C=CH-CH2, нека од којих су у свакодневној употреби.
Номенклатура и везивање
[уреди | уреди извор]Алил је широко кориштени термин у органској хемији.[5] Неспарени електрон је делокализован. Алилни радикали, ањони, и катјони се често разматрају као интермедијери у реакцијама. Сви садрже три суседна sp2-хибридизована угљенична центра.

Алилна места
[уреди | уреди извор]Место на засићеним атому угљеника се назива „алилна позиција“ или „алилно место“. Група везана за то место се понекад описује као „алилна“, нпр. CH2=CHCH2OH садржи алилну хидроксилну групу. Алилне C-H везе су за око 15% слабије од обичних C-Х веза на sp3 угљеничним центрима, те су реактивније. Ова повећана реактивност омогућава лаку оксидацију алилних C-H центара при продукцији ацрилонитрила.
Бензилна и алилна група су сродне у погледу структуре, јачине везе, и реактивности. Друге реакције алилних једињења су алилна оксидација, Алдер-ен реакција и Тсуји–Тростова реакција.
Пентадиенил
[уреди | уреди извор]CH2 група која повезује две винил групе је двоструко алилна. Енергија дисоцијације C-H везе на двоструко алилном центру је око 10% нижа од енергије алилне C-H везе. Ослабљене C-H везе одражавају високу стабилност резултујућег пентадиенилног радикала. Једињења која садрже C=C-CH2-C=C везе, нпр. деривати линолеинске киселине су склони аутоксидацији, која може да доведе до полимеризације или формирања семи чвртих материјала. Овај патерн реактивности је фундаментално сродан са формирањем филмова ланених уља, која су компоненте уљаних боја и лакова.
Хомоалил
[уреди | уреди извор]Термин хомоалилни се односи на позицију у угљеничном ланцу поред алилне позиције. У бут-3-енил хлориду CH2=CHCH2CH2Cl, hlorid zauzima homoalilnu poziciju.

Reference
[уреди | уреди извор]- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Morrison Robert Thornton; Boyd Robert Neilson (2006). Organic chemistry. Engelwood Cliffs, New Jersey: Prentice Hall. ISBN 8120307658.
- ^ Theodor Wertheim (1844). „Untersuchung des Knoblauchöls”. Annalen der Chemie und Pharmacie. 51 (3): 289. doi:10.1002/jlac.18440510302.
- ^ Block, Eric (2010). Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry. ISBN 978-0-85404-190-9.
- ^ Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
Literatura
[уреди | уреди извор]- Block, Eric (2010). Garlic and Other Alliums: The Lore and the Science. Royal Society of Chemistry. ISBN 978-0-85404-190-9.
