Стереоизомерија
Стереоизомери су једињења исте конституције а различитих конфигурација. Поједностављено, ово су једињења која имају идентичне супституенте али је просторни распоред тих супституената различит.
Енантиомерија[уреди | уреди извор]

Енантиомери су стереоизомери који се односе као предмет и лик у огледалу. Сваки стереоцентар једног енантиомера има супротну конфигурацију на одговарајућем хиралном атому другог енантиомера. Енантиомери имају идентичне физичке особине осим у једном аспекту: један енантиомер окреће раван поларизоване светлости улево, други удесно. По питању хемијских особина, постоји значајна разлика у реактивности енантиомера са другим оптички активним једињењима. Енантиомере је стога могуће разликовати или пропуштањем поларизоване светлости кроз њихов стандардизован раствор и мерењем угла за који раван светлости скреће, или у реакцији са неким хиралним реагенсом. У природи, важи правило да је најчешће један енантиомер заступљен у значајно већој мери од другог, као што је то случај код аминокиселина, што за последицу има и веома различиту биолошку активност енантиомера.
Дијастереоизомерија[уреди | уреди извор]
Дијастереоизомери су стереоизомери који се не односе као предмет и лик у огледалу, односно то су сви стереоизомери који нису енантиомери. Геометријска изомерија код неких класа једињења потпада под дијастереоизомерију, али се у најужем смислу односи на оптички активне не-енантиомерне облике једињења. У доле датом примеру, винска киселина има 2 хирална угљеникова атома, што значи да би по правилу требало да има 4 стереоизомера. Од тога се два, L-(+)-винска киселина и D-(-)-винска киселина односе као енантиомери, док друга два облика заправо представљају идентично једињење - мезо-винску киселину. Због присуства равни симетрије у овом облику, мезо-винска киселина не показује оптичку активност, али се са два енантиомерна облика односи као према дијастереоизомерима. Дијастереоизомери се готово увек разликују по физичким и хемијским особинама.

Геоматријска изомерија[уреди | уреди извор]
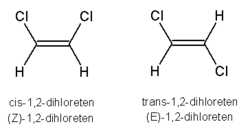

Стереоизомерија код једињења са двоструком везом јавља се услед релативне немогућности ротације око двоструке везе што значи да се супституенти налазе у сталном положају један у односу на други. О просторним одликама оваквих молекула не може се говорити уколико са било које стране двоструке везе (гледано у односу на раван нормалну на везу) постоје исти супституенти. Традиционални начин описивања стереохемије једињења са двоструком везом обухвата употребу cis-trans описа, преузетих од описивања положаја суспституената у цикличним једињењима као изнад или испод равни прстена. Cis-trans номенклатура се може користити само када су посматрани супституенти исти или слични. Нешто доследнији систем прописан од IUPAC-a, који се може користити и када посматрани супституенти нису идентични, али је могуће установити њихов редослед приоритета, обухвата додељивање приоритета сваком од супституената, након чега се конфигурација означава као E (нем. entgegen - супротно) уколико су супституенти виших приоритета на супротним странама двоструке везе, или Z (нем. zusammen - заједно) ако су супституенти са вишим приоритетом са исте стране двоструке везе. Врло често је Z конфигурација уједно и cis а E - trans, али како што се види у датим примерима, ово није правило.
Конформације[уреди | уреди извор]
Конформације представљају различите просторне облике неког једињења који настају ротацијом око једне или више једноструких веза. Различите конформације имају различите садржаје енергије што зависи од низа фактора и интеракција у самом молекулу. У зависности од броја једноструких веза и природе самог молекула, он се може наћи у већем броју конформација, међутим, практично је немогуће изоловати појединачни облик, односно одвојити га од осталих. Такав пример је циклохексан, који се јавља у конформацији „столице“ и „лађе“, али је ове две немогуће раздвојити једну од друге. Код неких једињења као што су 2,2,2,2-тетрасупстутуисани бифенили, ово је, пак, могуће због великих енергетских баријера између две конформације. Ова појава се назива атропизомерија и може се сматрати једним видом енантиомерије, мада је неки аутори издвајају засебно.
Литература[уреди | уреди извор]
- Ernest L. Eliel; Samuel H. Wilen (1994). Stereochemistry of Organic Compounds (1 изд.). Wiley, John & Sons, Incorporated. ISBN 978-0-471-01670-0.
- Ernest L. Eliel; Samuel H. Wilen; Michael P. Doyle (2001). Basic Organic Stereochemistry (1. изд.). Wiley-Interscience. ISBN 978-0-471-37499-2.
- Kurt Martin Mislow Kurt Mislow (15. 1. 2003). Introduction to Stereochemistry. Dover Publications. ISBN 978-0-486-42530-6.
- D. Nasipuri (1994). Stereochemistry of Organic Compounds: Principles and Applications (2. изд.). South Asia Books. ISBN 978-81-224-0570-5.
