Amonijum
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Amonijum
| |||
| Sistemski IUPAC naziv
Azanijum[1] | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| MeSH | D000644 | ||
| |||
| Svojstva | |||
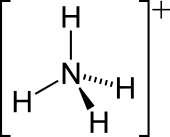
| NH+ 4 | |||
| Molarna masa | 18,04 g·mol−1 | ||
| Kiselost (pKa) | 9.25 | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Tetraedralna | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
Amonijum katjon je pozitivno naelektrisani poliatomski jon sa hemijskom formulom NH+
4. On se formira protonacijom amonijaka (). Amonijum je isto tako opšte ime za pozitivno naelektrisane ili protonovane supstituisane amine i kvaternarne amonijum katjone (NR+
4), gde je jedan ili više atoma vodonika zamenjen organskom grupom (označenom sa R).
Kiselo bazna svojstva
[уреди | уреди извор]
Amonijumski jon se formira kad amonijak, koji je slaba baza, reaguje sa Brenstedovim kiselinama (donorima protona):
- H+ + NH3 → NH+
4
Amonijum jon je blago kiseo i reaguje sa Brenstedovim bazama, pri čemu se vraća u nenaelektrisani molekul amonijaka:
- NH+
4 + B− → HB + NH3
Tretman koncentrovanih rastvora amonijačnih soli sa jakom bazom dovodi do oslobađanja amonijaka. Kad je amonijak rastvori u vodi, mala količina se pretvara u amonijumske jone:
- H2O + NH3 ⇌ OH− + NH+
4
Stepen u kome amonijak formira amonijačne jone zavisi od pH vrednosti rastvora. Ako je pH nizak, ravnoteža se pomera na desno: više amonijačnih molekula se konvertuje u amonijum jone. Ako je pH visok (koncentracija vodoničnih jona je niska), ravnoteža se pomera na levo: hidroksidni jon apstrahuje proton iz amonijum jona i generiše amonijak.
Formiranje amonijumskih jedinjenja se isto tako može odvijati u parnoj fazi; na primer, kad amonijačna para dođe u kontakt sa hlorovodoničnom parom, nastaje beli oblak amonijum hlorida, koji se vremenom sleže u vidu čvrstog tankog belog sloja na površinama.
Konverzija amonijuma nazad u amonijak se lako ostvaruje dodavanje jake baze.
Amonijum soli
[уреди | уреди извор]
Amonijum katjon je prisutan u raznim solima kao što su amonijum karbonat, amonijum hlorid, i amonijum nitrat. Najjednostavnije amonijum soli su veoma rastvorne u vodi. Jedan izuzetak je amonijum heksahloroplatinat, čije formiranje je nekad korišteno kao test za amonijum. Amonijum soli nitrata i posebno perhlorata su veoma eksplozivne. U tim slučajevima amonijum je redukujući agenas.
U jednom neobičnom procesu, amonijum joni formiraju amalgam. Ovakva jedinjenja se pripremaju elektrolizom amonijum rastvora koristeći živinu katodu.[4] Ovako formiran amalgam se vremenom razlaže uz otpuštanje amonijaka i vodonika.[5]
Reference
[уреди | уреди извор]- ^ Међународна унија за чисту и примењену хемију (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): Royal Society of Chemistry – IUPAC. ISBN 0-85404-438-8. pp. 71,105,314. Electronic version.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „Pseudo-binary compounds”. Архивирано из оригинала 27. 07. 2020. г. Приступљено 20. 04. 2018.
- ^ „Ammonium Salts”. VIAS Encyclopedia.



