Hidronijum — разлика између измена
svg (GlobalReplace v0.6.5) |
. |
||
| Ред 15: | Ред 15: | ||
| ImageNameR1 = Spacefill model of hydronium |
| ImageNameR1 = Spacefill model of hydronium |
||
| IUPACName = Hidronijum jon<ref name="Clayden1st">{{Clayden1st}}</ref> |
| IUPACName = Hidronijum jon<ref name="Clayden1st">{{Clayden1st}}</ref> |
||
| SystematicName = Oksidanijum<ref name = "oxonium (CHEBI:29412)" >{{Cite web|url = https://www.ebi.ac.uk/chebi/searchId.do?chebiId=29412|title = oxonium (CHEBI:29412)|work = Chemical Entities of Biological Interest (ChEBI)|location = UK| |
| SystematicName = Oksidanijum<ref name = "oxonium (CHEBI:29412)" >{{Cite web|url = https://www.ebi.ac.uk/chebi/searchId.do?chebiId=29412|title = oxonium (CHEBI:29412)|work = Chemical Entities of Biological Interest (ChEBI)|location = UK |author = European Bioinformatics Institute}}</ref> (substitutivno)<br /> |
||
Trihidridokiseonik(1+)<ref name = "oxonium (CHEBI:29412)" /> (aditivno) |
Trihidridokiseonik(1+)<ref name = "oxonium (CHEBI:29412)" /> (aditivno) |
||
| Section1 = {{Chembox Identifiers-lat |
| Section1 = {{Chembox Identifiers-lat |
||
| Ред 44: | Ред 44: | ||
}} |
}} |
||
U [[hemija|hemiji]], '''hidronijum''' [[jon]] je [[katjon]] {{chem|H|3|O|+}}. To je tip [[oksonijum jon]]a proizvedenog [[protonacija|protonacijom]] [[voda|vode]]. Ovaj katjon se često koristi za predstavljanje prirode [[proton]]a u vodenom rastvoru, gde je proton visoko solvatisan (vezan za rastvarač). Realnost je daleko komplikovanija, i proton se vezuje za nekoliko molekula vode, tako da su druge notacije poput -{H<sub>5</sub>O<sub>2</sub><sup>+</sup>, H<sub>7</sub>O<sub>3</sub><sup>+</sup>}- i -{H<sub>9</sub>O<sub>4</sub><sup>+</sup>}- tačniji opisi okruženja protona u vodi.<ref name="Greenwd">{{Greenwood&Earnshaw2nd}}</ref> Jon {{chem|H|3|O|+}} je bio detektovan u gasovitoj fazi.<ref>{{cite journal | doi=10.1103/PhysRevLett.51.554 | title=Detection of the Hydronium Ion (H_{3}O^{+}) by High-Resolution Infrared Spectroscopy | year=1983 | author=Begemann M. |
U [[hemija|hemiji]], '''hidronijum''' [[jon]] je [[katjon]] {{chem|H|3|O|+}}. To je tip [[oksonijum jon]]a proizvedenog [[protonacija|protonacijom]] [[voda|vode]]. Ovaj katjon se često koristi za predstavljanje prirode [[proton]]a u vodenom rastvoru, gde je proton visoko solvatisan (vezan za rastvarač). Realnost je daleko komplikovanija, i proton se vezuje za nekoliko molekula vode, tako da su druge notacije poput -{H<sub>5</sub>O<sub>2</sub><sup>+</sup>, H<sub>7</sub>O<sub>3</sub><sup>+</sup>}- i -{H<sub>9</sub>O<sub>4</sub><sup>+</sup>}- tačniji opisi okruženja protona u vodi.<ref name="Greenwd">{{Greenwood&Earnshaw2nd}}</ref> Jon {{chem|H|3|O|+}} je bio detektovan u gasovitoj fazi.<ref>{{cite journal | doi=10.1103/PhysRevLett.51.554 | title=Detection of the Hydronium Ion (H_{3}O^{+}) by High-Resolution Infrared Spectroscopy | year=1983 | author=Begemann M. |display-authors=etal | journal=Physical Review Letters | volume=51 | issue=7 | pages=554–557}}</ref> |
||
== Određivanje -{pH}- vrednosti == |
== Određivanje -{pH}- vrednosti == |
||
| Ред 59: | Ред 59: | ||
== Reference == |
== Reference == |
||
{{reflist|2}} |
{{reflist|2}} |
||
== Literatura == |
|||
== Spoljašnje veze == |
== Spoljašnje veze == |
||
| ⚫ | |||
{{Commonscat-lat|Hydronium ion}} |
{{Commonscat-lat|Hydronium ion}} |
||
* [http://efie.net/change/understanding-to-the-hydronium-ion/ Hidronijum jon] |
* [http://efie.net/change/understanding-to-the-hydronium-ion/ Hidronijum jon] |
||
| ⚫ | |||
{{DEFAULTSORT:Хидронијум}} |
{{DEFAULTSORT:Хидронијум}} |
||
Верзија на датум 21. октобар 2017. у 07:53
| |||
| |||
| Nazivi | |||
|---|---|---|---|
| IUPAC naziv
Hidronijum jon[1]
| |||
| Sistemski IUPAC naziv | |||
| Identifikacija | |||
3D model (Jmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| Gmelin Referenca | 141 | ||
| MeSH | Hydronium+ion | ||
| |||
| Svojstva | |||
| H 3O+ | |||
| Molarna masa | 19,0232 g mol-1 | ||
| Kiselost (pKa) | -1.74[5] | ||
| Termohemija | |||
| Standardna molarna entropija S |
192.25 J K-1 mol-1 | ||
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |||
| Reference infokutije | |||
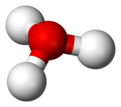
U hemiji, hidronijum jon je katjon H
3O+
. To je tip oksonijum jona proizvedenog protonacijom vode. Ovaj katjon se često koristi za predstavljanje prirode protona u vodenom rastvoru, gde je proton visoko solvatisan (vezan za rastvarač). Realnost je daleko komplikovanija, i proton se vezuje za nekoliko molekula vode, tako da su druge notacije poput H5O2+, H7O3+ i H9O4+ tačniji opisi okruženja protona u vodi.[6] Jon H
3O+
je bio detektovan u gasovitoj fazi.[7]
Određivanje pH vrednosti
Odnos koncentracije hidronijum jon i hidroksida određuje pH vrednost rastvora. Molekuli u čistoj vodi se disociraju u hidronijum i hidroksilne jone uspostavljajući sledeću ravnotežu:
- 2 H
2O ⇌ OH−
+ H
3O+
U čistoj vodi, postoji jednak broj hidroksid i hidronijum jona, tako da ona ima neutralni pH od 7. pH vrednost manja od 7 indicira kiseli rastvor, dok je pH iznad 7 svojstven za bazne rastvore. (Treba napomenuti da ovo važi na 25°C, i da je ravnoteža zavisna od temperature).
Vidi još
Reference
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ а б European Bioinformatics Institute. „oxonium (CHEBI:29412)”. Chemical Entities of Biological Interest (ChEBI). UK.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Taft, R.W., Wolf, J.F., Beauchamp, J.L., Scorrano, G., Arnett, E.M., J. Am. Chem. Soc., 1978, 100, 1240.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
- ^ Begemann M.; et al. (1983). „Detection of the Hydronium Ion (H_{3}O^{+}) by High-Resolution Infrared Spectroscopy”. Physical Review Letters. 51 (7): 554—557. doi:10.1103/PhysRevLett.51.554.


