Јон

Јон је наелектрисани атом или група атома. Процес стварања јона из неутралних честица назива се јонизација. Јонско наелектрисање потиче од губитка или добитка електрона. Пошто је набој електрона (који се по конвенцији сматра „негативним”) једнак и супротан протонском (који се сматра „позитивним” по конвенцији), нето набој јона се разликује од нуле, јер је његов укупни број електрона неједнак укупном броју протона. Негативно наелектрисани јон се зове анјон, јер га привлачи позитивно наелектрисана анода, а позитивно наелектрисан јон је катјон, јер га привлачи негативно наелектрисана катода. Због њихових супротних електричних набоја, катјони и анјони се међусобно привлаче и лако формирају јонска једињења.
Јони који се састоје само од једног атома се називају атомским или моноатомским јонима, док два или више атома формирају молекуларне јоне или полиатомске јоне. У случају физичке јонизације у медијуму, као што ус гасови, „јонски парови” се креирају путем јонских колизија, где се сваки генерисани пар састоји од слободног електрона и позитивног јона.[1] Јони се исто тако креирају путем хемијских интеракција, као што је растварање соли у ликвидима, или на неки други начин, као што је пропуштање једносмерне струје кроз проводни раствор, при чему се раствара анода јонизацијом.
Историја[уреди | уреди извор]
Реч јон потиче од грчек речи ἰόν, јон, „иде”, презент партицип од ἰέναι, ienai, „ићи”. Јоне је први помињао (након сугестије Вилијама Вевела[2]) Мајкл Фарадеј око 1830. како би описао честице које се крећу према катоди или аноди у воденом раствору.[3][4] Фарадеј није познавао природу ових врста, али је знао да се метали растварају и улазе у раствор на једној електроди и нови метал излази из раствора на другој електроди; да се нека врста супстанце кретала кроз раствор у струји. Тиме се преноси материја са једног места на друго. У складу са Фарадејем, Вевел је такође сковао речи анода и катода, као и анјон и катјон за јоне које привлаче одговарајуће електроде.[2]
Механизам по коме се јонизација дешава није описан све до 1884. када ју је Сванте Аренијус описао у докторској дисертацији на Универзитету у Упсали. Његова теорија првобитно није била прихваћена (оцењен је најмањем пролазном оценом), али је касније добио Нобелову награду за хемију 1903. за исту дисертацију.[5] Аренијусово објашњење је било да се при формирању раствора, соли дисоцирају у Фарадејове јоне. Аренијус је предложио да се јони формирају и у одсуству електричне струје.[6][7][8]
Карактеристике[уреди | уреди извор]
Јони у стању сличном гасу су високо реактивни и брзо реагују са јонима супротног набоја дајући неутралне молекуле или јонске соли. Јони се такође формирају у течном или чврстом стању када соли интерагују са растварачима (на пример, водом) чиме се формирају „солватирани јони”, који су стабилнији, из разлога који обухватају комбинацију промена енергије и ентропије док се јони међусобно удаљавају да би реаговали са течношћу. Ове стабилизоване врсте се чешће јављају у средини при ниским температурама. Уобичајени пример су јони присутни у морској води, који су изведени из растворених соли.
Као наелектрисани објекти, јони бивају привучени супротним електричним набојем (позитиван негативним и обрнуто) а одбијају се истоимени набоји. Када се крећу, њихове путање се могу скренути магнетним пољем.
Електрони, услед њихове мале масе и стога својства попуњавања већег простора у виду материјалних таласа, одређују величину атома и молекула који поседују електроне. Стога, анјони (негативно наелектрисани јони) већи су од родитељског молекула или атома, пошто се додатни електрони међусобно одбијају и увећавају физичку величину јона, чија је величина одређена његовим облаком електрона. Катјони су мањи од одговарајућег родитељског атома или молекула због мање величине електронског облака. Један специфични катјон (водоников) не садржи електроне, и стога се састоји од једног протона - много мањег од родитељског атома.
Анјони и катјони[уреди | уреди извор]
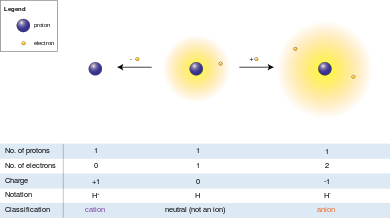
Пошто је електрични набој на протону једнак по магнитуди набоју на електрону, нето електрични набој на јону једнак је броју протона у јону минус број електрона.
Анјон (−), од грчке речи ἄνω (ánō), са значењем „горе”,[9] јон је са више електрона неко протона, што му даје негативно наелектрисање (пошто су електрони негативно наелектрисани и протони су позитивно наелектрисани).[10]
Катјон (+), од грчке речи κάτω (káto), са значењем „доле”,[11] јон је са мање електрона него протона, што му даје позитивно наелектрисање.[12]
Постоје додатна имена која се користе за јоне са вишеструким наелектрисањима. На пример, јон са −2 наелектрисањем је познат као дианјон а јон са +2 наелектрисањем је познат као дикатјон. Цвитерјон је неутрални молекул са позитивним и негативним наелектрисањем на различитим локацијама унутар тог молекула.[13]
Катјони и анјони се мере по њиховом јонском радијусу и они се разликују по њиховој релативној величини: „Катјони су мали, већина њих је мања од 10−10 m (10−8 cm) у радијусу. Већина анјона је велика, као што је и најзаступљенији Земљин анјон, кисеоник. Из ове чињенице следи да већину простора у кристалу заузимају анјони и да се катјони смештају у простор између њих.”[14]
Катјон има радијус мањи од 0,8 × 10−10 m (0,8 Å) док анјон има радијус већи од 1,3 × 10−10 m (1,3 Å).[15]
Природне појаве[уреди | уреди извор]
Јони су свеприсутни у природи и они су одговорни за разнолике појаве од луминесценције Сунца до постојања Земљине јоносфере. Атоми у њиховом јонском стању могу да имају различиту боју од неутралних атома, па тако апсорпција светлости металним јонима даје боју драгог камења. У неорганској и органској хемији (укључујући биохемију), интеракција воде и јона је изузетно важна. Један пример тога је енергија која покреће разградњу аденозин трифосфата (АТП). Следеће секције описују контексте у којима јони имају истакнуто место; оне су уређене по опадајућој физичкој величини, од астрономских до микроскопских.
Сродна технологија[уреди | уреди извор]
Јони могу бити нехемијски припремљени користећи различите изворе јона, обично путем примене високог напона или температуре. Они се користе у великом броју уређаја као што су масени спектрометри, оптички емисиони спектрометри, акцелератори честица, јонски имплантати и јонски мотори. Као реактивне наелектрисане честице, они се такође користе у пречишћавању ваздуха за сузбијање микроба, као и у кућним уређајима као што су детектори дима.
Сигнализација и метаболизам у организмима се контролишу прецизним јонским градијентом преко мембрана, и стога поремећај овог градијента доприноси смрти ћелија. Ово је заједнички механизам који се користи од природних и вештачких биоцида, укључујући јонско канални грамицидин и амфотерицин (фунгицид).
Неоргански растворени јони су компоненте укупних растворених чврстих материја, што је широко познати индикатор квалитета воде.
Јонизациони потенцијал[уреди | уреди извор]
Јонизациони потенцијал или енергија јонизације, представља рад који се изврши приликом уклањања једног електрона из датог система, дакле рад да се створи одређени јон. (То је рад да се електрон одведе на бесконачно велико растојање.) Код чврстих тела и течности јонизациони потенцијал зависи од локалних услова па не представља нарочито стабилну константу. Међутим за изоловани атом (дакле, атом у гасној фази на врло ниском притиску) јонизациони потенцијали су карактеристичне константе које има смисла табулирати.
За хемијске елементе, јонизационе енергије опадају надоле у групи Периодног система елемената, и расту слева надесно у периоди. Ови трендови су управо супротни периодичним трендовима атомског пречника. Електроне у мањим атомима језгро јаче привлачи, и стога је енергија јонизације већа. У већим атомима, електрони нису привучени толико снажном силом, па је стога енергија јонизације мања.
| Елемент | Прва | Друга | Трећа | Четврта | Пета | Шеста | Седма |
|---|---|---|---|---|---|---|---|
| Na | 496 | 4560 | |||||
| Mg | 738 | 1450 | 7730 | ||||
| Al | 577 | 1816 | 2744 | 11600 | |||
| Si | 786 | 1577 | 3228 | 4354 | 16100 | ||
| P | 1060 | 1890 | 2905 | 4950 | 6270 | 21200 | |
| S | 999 | 2260 | 3375 | 4565 | 6950 | 8490 | 11000 |
| Cl | 1256 | 2295 | 3850 | 5160 | 6560 | 9360 | 11000 |
| Ar | 1520 | 2665 | 3945 | 5770 | 7230 | 8780 | 12000 |
| Сукцесивне енергије јонизације у kJ/mol | |||||||
Прва енергија јонизације је енергија неопходна да се уклони електрон са изолованог неутралног атома, друга да се уклони електрон са изолованог +1 јона, и тако даље. Следећа енергија јонизације је увек већа од претходне, те ће n-та енергија јонизације бити знатно већа од осталих. Међутим пораст није линеаран већ прати структуру електронског омотача код атома. По правилу најлакше је извлачити електроне из тек започетих љуски. На пример, натријум се налази као Na+, али обично не као Na2+ услед велике јонизационе енергије за другу јонизацију. Слично, магнезијум се јавља као Mg2+, али не и као Mg3+ док алуминијум може постојати као Al3+ катјон. Ово је последица тога да натријум има један, магнезијум два а алуминијум три електрона у недовршеној последњој љуски.
Етимологија[уреди | уреди извор]
Реч јон је име које је наденуо Мајкл Фарадеј, од грчке речи ἰόν, неутрални презент партицип од ἰέναι, „ићи“, стога „који иде“. Тако, анјон, ἀνιόν, и катјон, κατιόν, значи „(ствар која) иде горе“ и „(ствар која) иде доле“, редом, и анода, ἄνοδος, и катода, κάθοδος, значи „иде горе“ и „иде доле“, редом, од ὁδός, „пут“.
Референце[уреди | уреди извор]
- ^ Knoll 1999
- ^ а б Frank A. J. L. James (ур.). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. стр. 183. ISBN 9780863412493.
- ^ Michael Faraday (1791—1867). UK: BBC.
- ^ „Online etymology dictionary”. Приступљено 7. 1. 2011.
- ^ „The Nobel Prize in Chemistry 1903”. www.nobelprize.org.
- ^ Harris, William; Levey, Judith, ур. (1975). The New Columbia Encyclopedia (4th изд.). New York City: Columbia University. стр. 155. ISBN 978-0-231-03572-9.
- ^ Goetz, Philip W. (1992). McHenry, Charles, ур. The New Encyclopædia Britannica. Chicago: Encyclopaedia Britannica Inc. 1 (15 изд.). Chicago: Encyclopædia Britannica, Inc. стр. 587. Bibcode:1991neb..book.....G. ISBN 978-0-85229-553-3.
- ^ Cillispie, Charles, ур. (1970). Dictionary of Scientific Biography (1 изд.). New York City: Charles Scribner's Sons. стр. 296—302. ISBN 978-0-684-10112-5.
- ^ Oxford University Press (2013). „Oxford Reference: OVERVIEW anion”. oxfordreference.com.
- ^ University of Colorado Boulder (21. 11. 2013). „Atoms and Elements, Isotopes and Ions”. colorado.edu. Архивирано из оригинала 13. 05. 2021. г. Приступљено 05. 06. 2019.
- ^ Oxford University Press (2013). „Oxford Reference: OVERVIEW cation”. oxfordreference.com.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007—2008). „Elemental Chemistry” (PDF). usouthal.edu.
- ^ Purdue University (21. 11. 2013). „Amino Acids”. purdue.edu.
- ^ Frank Press & Raymond Siever (1986) Earth, 14th edition, p. 63, W.H. Freeman and Company. ISBN 978-0-7167-1743-0.
- ^ Linus Pauling (1960) Nature of the Chemical Bond на сајту Гугл књиге
Литература[уреди | уреди извор]
- Frank A. J. L. James (ур.). The Correspondence of Michael Faraday, Vol. 2: 1832-1840. стр. 183. ISBN 9780863412493.
- Knoll, Glenn F (1999). Radiation detection and measurement (3rd изд.). New York: Wiley. ISBN 978-0-471-07338-3.
Додатна литература[уреди | уреди извор]
- Laidler, Keith James (1995). The World of Physical Chemistry. Oxford University Press. ISBN 978-0-19-855919-1.
Спољашње везе[уреди | уреди извор]
- Servos, John W. (1990). Physical Chemistry from Ostwald to Pauling: The Making of a Science in America. Princeton University Press. ISBN 0691026149.
