Ribonukleazni inhibitor
| Ponavljanje bogato leucinom | |||||||||
|---|---|---|---|---|---|---|---|---|---|
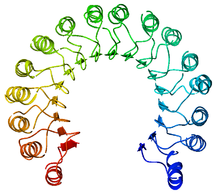 Pogled od gore na svinjski ribonukleazni inhibitor, prikazuje njegov oblik potkovice.[1] Spoljašnji sloj se sastoji od α-heliksa, a unutrašnji od paralelni β-lanaca. Unutrašnji i spoljašnji prečnik su oko 2.1 nm i 6.7 nm, respektivno. | |||||||||
| Identifikatori | |||||||||
| Simbol | LRR_1 | ||||||||
| Pfam | PF00560 | ||||||||
| Pfam klan | CL0022 | ||||||||
| InterPro | IPR003590 | ||||||||
| SMART | SM00368 | ||||||||
| SCOP | 1bnh | ||||||||
| SUPERFAMILY | 1bnh | ||||||||
| |||||||||
Ribonukleazni inhibitor (RI) je veliki (~450 ostataka, ~49 kDa), kiseli (pI ~4.7), protein ponavljanja bogatih leucinom, koji formira ekstremno čvrste komplekse sa pojedinim ribonukleazama. On je jedan od glavnih ćelijskih proteina. On sačinjava ~0.1% svih ćelijskih proteina po težini, i ima važnu ulogu u regulisanju životnog veka RNK.[2]
RI ima iznenađujućie visok sadržaj cisteina (~6.5%, cf. 1.7% za tipične proteine) i senzitivan je na oksidaciju. RI je isto tako bogat leucinom (21.5%, u poređenju sa 9% kod tipičnih proteina) i ima proporcionalno niži udeo drugih hidrofobnih ostataka, posebno valina, izoleucina, metionina, tirozina, i fenilalanina.
Struktura[уреди | уреди извор]

RI je klasični protein ponavljanja bogatog leucinom, koji se sastoji od naizmeničnih α-heliksa i β-lanaca duž svoje osnove. Ovi elementi sekundarne strukture su omotani u zakrivljeni, desnoruki solenoid koji podseća na potkovicu. Paralelni β-lanci i α-heliksi formiraju unutrašnji i spoljašnji zid potkovice, respektivno. Struktura je stabilizovana unutrašnjim asparaginima u bazi svakog zaokreta, kad lanac prelazi iz α-heliksa u β-ravan. αβ motiv sa 28 do 29 ostataka se alternativno ponavlja, efektivno formirajući 57-ostataka dugu jedinicu koja korespondira svojoj genetičkoj strukturi (svaki ekson kodira 57-ostataka dugu jedinicu).
Vezivanje za ribonukleaze[уреди | уреди извор]
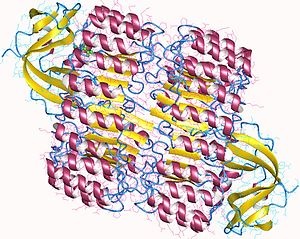
Afinitet RI za ribonukleaze je jedan od najviših među poznatim protein-protein interakcijama; konstanta disocijacije kompleksa RI-RNaze A je femtomolarnog (fM) reda veličine pod fiziološkim uslovima, dok je Kd vrednost za kompleks RI-angiogenin manja 1 fM. Uprkos visokog afiniteta, RI može da veže širok opseg RNaza A, mada one imaju relativno nizak indentitet sekvenci. Rezultati biohemijskih studija i razmatranja kristalografskih struktura kompleksa RI-RNaze A ukazuju na činjenicu da su interakcije prevashodno elektrostatičke prirode, kao i da postoje znatne zaklonjene površine.[3][4] RI afinitet za ribonukleaze je važan, pošto mnoge ribonukleaze proizvode citotoksične i citostatičke efekte koji su u dobroj korelaciji sa njihovom sposobnosti vezivanja RI.[5]
Ribonukleazni inhibitori sisara nemaju sposobnost vezivanja pojedinih članova pankreasnih ribonukleaza iz drugih vrsta. Specifično, na amfibijske RNaze, kao što su ranpirnaza i amfinaza iz severnih leopardskih žaba, ne utiču RI sisara i uočeno je da one manifestuju diferencijalnu citotoksičnost za ćelije raka.[6]
Reference[уреди | уреди извор]
- ^ а б PDB: 2BNH; Kobe B, Deisenhofer J (1993). „Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats”. Nature. 366 (6457): 751—6. PMID 8264799. doi:10.1038/366751a0.
- ^ Shapiro R (2001). „Cytoplasmic ribonuclease inhibitor”. Methods in Enzymology. 341: 611—28. PMID 11582809. doi:10.1016/S0076-6879(01)41180-3.
- ^ Lee FS, Shapiro R, Vallee BL (1989). „Tight-binding inhibition of angiogenin and ribonuclease A by placental ribonuclease inhibitor”. Biochemistry. 28 (1): 225—30. PMID 2706246. doi:10.1021/bi00427a031.
- ^ Papageorgiou AC, Shapiro R, Acharya KR (1997). „Molecular recognition of human angiogenin by placental ribonuclease inhibitor--an X-ray crystallographic study at 2.0 A resolution”. The EMBO Journal. 16 (17): 5162—77. PMC 1170149
 . PMID 9311977. doi:10.1093/emboj/16.17.5162.
. PMID 9311977. doi:10.1093/emboj/16.17.5162.
- ^ Makarov AA, Ilinskaya ON (2003). „Cytotoxic ribonucleases: molecular weapons and their targets”. FEBS Letters. 540 (1-3): 15—20. PMID 12681476. doi:10.1016/s0014-5793(03)00225-4.
- ^ Ardelt W, Shogen K, Darzynkiewicz Z (2008). „Onconase and amphinase, the antitumor ribonucleases from Rana pipiens oocytes”. Current Pharmaceutical Biotechnology. 9 (3): 215—25. PMC 2586917
 . PMID 18673287. doi:10.2174/138920108784567245.
. PMID 18673287. doi:10.2174/138920108784567245.
Literatura[уреди | уреди извор]
- Kobe B, Deisenhofer J (1995). „A structural basis of the interactions between leucine-rich repeats and protein ligands”. Nature. 374 (6518): 183—6. PMID 7877692. doi:10.1038/374183a0.
- Kobe B, Deisenhofer J (1996). „Mechanism of ribonuclease inhibition by ribonuclease inhibitor protein based on the crystal structure of its complex with ribonuclease A”. Journal of Molecular Biology. 264 (5): 1028—43. PMID 9000628. doi:10.1006/jmbi.1996.0694.
- Papageorgiou AC, Shapiro R, Acharya KR (1997). „Molecular recognition of human angiogenin by placental ribonuclease inhibitor--an X-ray crystallographic study at 2.0 A resolution”. The EMBO Journal. 16 (17): 5162—77. PMC 1170149
 . PMID 9311977. doi:10.1093/emboj/16.17.5162.
. PMID 9311977. doi:10.1093/emboj/16.17.5162. - Suzuki M, Saxena SK, Boix E, Prill RJ, Vasandani VM, Ladner JE, Sung C, Youle RJ (1999). „Engineering receptor-mediated cytotoxicity into human ribonucleases by steric blockade of inhibitor interaction”. Nature Biotechnology. 17 (3): 265—70. PMID 10096294. doi:10.1038/7010.
- Shapiro R, Ruiz-Gutierrez M, Chen CZ (2000). „Analysis of the interactions of human ribonuclease inhibitor with angiogenin and ribonuclease A by mutagenesis: importance of inhibitor residues inside versus outside the C-terminal "hot spot"”. Journal of Molecular Biology. 302 (2): 497—519. PMID 10970748. doi:10.1006/jmbi.2000.4075.
- Bretscher LE, Abel RL, Raines RT (2000). „A ribonuclease A variant with low catalytic activity but high cytotoxicity”. The Journal of Biological Chemistry. 275 (14): 9893—6. PMID 10744660. doi:10.1074/jbc.275.14.9893.
- Yakovlev GI, Mitkevich VA, Makarov AA (2006). „Ribonuclease inhibitors”. Molecular Biology. 40 (6): 867—874. doi:10.1134/S0026893306060045.[мртва веза]
