α-Aminoadipatni put
α-Аминоадипатни пут је биохемијски пут за синтезу аминокиселине L-лизин. Код еукариота, овај пут је јединствен за више гљиве (које садрже хитин у својим ћелијским зидовима) и еуглениде.[1] Такође је уочен од бактерија рода Тхермус.[2]
Преглед пута
[уреди | уреди извор]Хомоцитрат се иницијално синтетише из ацетил-КоА и 2-оксоглутарата помоћу хомоцитратне синтазе. Ово се затим претвара у хомоаконитат помоћу хомоаконитазе, а затим у хомоизоцитрат помоћу хомоизоцитрат дехидрогеназе. Атом азота се додаје из глутамата помоћу аминоадипат аминотрансферазе да би се формирао α-аминоадипат по коме је овај пут добио име. Ово се затим редукује помоћу аминоадипат редуктазе преко ацил-ензимског интермедијера у полуалдехид. Реакција са глутаматом једне класе сахаропин дехидрогеназе даје сахаропин који се затим цепа другом сахаропин дехидрогеназом да би се добио лизин и оксоглутарат.[3]
α-Аминоадипинска киселина
[уреди | уреди извор]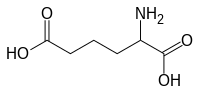
| |
| Називи | |
|---|---|
| IUPAC назив
2-Aminoheksandionska kiselina
| |
| Други називи
2-Аминоадипинска киселина
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChEBI | |
| ChemSpider | |
| МеСХ | 2-Аминоадипиц+Ацид |
| УНИИ | |
| |
| Својства | |
| C6H11NO4 | |
| Моларна маса | 161,156 g/mol |
| Агрегатно стање | Кристална |
| Густина | 1,333 g/mL |
| Тачка топљења | 196 °C (385 °F; 469 K) |
| Тачка кључања | 364 °C (687 °F; 637 K) |
| Опасности | |
| Опасност у току рада | Ирритант |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
α-Аминоадипинска киселина је коњугована киселина α-аминоадипата, од којих је потоњи преовлађујући облик при физиолошком пХ. Једна студија из 2013. идентификовала је α-аминоадипинску киселину (2-аминоадипинску киселину) као нови предиктор развоја дијабетеса и сугерисала да је она потенцијални модулатор хомеостазе глукозе код људи.[6]
Референце
[уреди | уреди извор]- ^ Забриские ТМ, Јацксон MD (2000). „Лyсине биосyнтхесис анд метаболисм ин фунги”. Натурал Продуцт Репортс. 17 (1): 85—97. ПМИД 10714900. дои:10.1039/а801345д.
- ^ Косуге Т, Хосхино Т (1999). „Тхе α-аминоадипате патхwаy фор лyсине биосyнтхесис ис wиделy дистрибутед амонг Тхермус страинс”. Јоурнал оф Биосциенце анд Биоенгинееринг. 88 (6): 672—5. ПМИД 16232683. дои:10.1016/С1389-1723(00)87099-1.
- ^ Xу Х, Анди Б, Qиан Ј, Wест АХ, Цоок ПФ (2006). „Тхе α-аминоадипате патхwаy фор лyсине биосyнтхесис ин фунги”. Целл Биоцхемистрy анд Биопхyсицс. 46 (1): 43—64. ПМИД 16943623. С2ЦИД 22370361. дои:10.1385/ЦББ:46:1:43.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Wang TJ, Ngo D, Psychogios N, Dejam A, Larson MG, Vasan RS, Ghorbani A, O'Sullivan J, Cheng S, Rhee EP, Sinha S, McCabe E, Fox CS, O'Donnell CJ, Ho JE, Florez JC, Magnusson M, Pierce KA, Souza AL, Yu Y, Carter C, Light PE, Melander O, Clish CB, Gerszten RE (2013). „2-Aminoadipic acid is a biomarker for diabetes risk”. Journal of Clinical Investigation. 123 (10): 4309—4317. PMC 3784523
 . PMID 24091325. doi:10.1172/JCI64801.
. PMID 24091325. doi:10.1172/JCI64801.
