Гвожђе оксид

Оксиди гвожђа су хемијска једињења која се састоје од гвожђа и кисеоника. Све заједно, познато је шеснаест оксида и оксихидроксида гвожђа.[1]
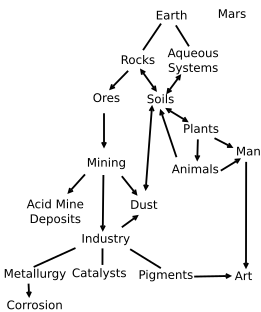
Оксиди гвожђа и оксид-хидроксиди су широко распростањени у природи, играју важну улогу у многим геолошким и биолошким процесима, и људи и широко користе, е.г., као руде гвожђа, пигменти, катализатори, у термитима и хемоглобину. Обична рђа је форма гвожђе(III) оксида. Оксиди гвожђа су у широкој употреби као јефтини, дуготрајни пигменти у бојама, превлакама и обојеним бетонима. Обично доступне боје су опсегу "земљишне" жуте/наранџате/црвене/смеђе/црне боје. Кад се користе као боја за храну имају Е број Е172.
Оксиди
[уреди | уреди извор]

- гвожђе(II) оксид, вустите (FeO)
- гвожђе(II,III) оксиди:
- гвожђе(III) оксид (Fe2O3)
Хидроксиди
[уреди | уреди извор]- гвожђе(II) хидроксид (Fe(OH)2)
- гвожђе(III) хидроксид (Fe(OH)3), (берналит)
Оксид/хидроксиди
[уреди | уреди извор]- гетит (α-FeOOH),
- акаганеит (β-FeOOH),
- лепидокрокит (γ-FeOOH),
- фероксихит (δ-FeOOH),
- ферихидрит ( апрокс.), или , или
- FeOOH високог притиска
- Швертманит (идеално ор )[6]
- зелена рђа ( где је А− Цл− или 0.5СО42−)
Микробна деградација
[уреди | уреди извор]Неколико врста бактерија, укључујучи Shewanella oneidensis, Geobacter sulfurreducens и Geobacter metallireducens метаболички користе чврсте оксиде гвожђа као терминалне рецепторе електрона, редукујући Fe(III) оксиде до Fe(II) оксида.[7]
Види још
[уреди | уреди извор]Референце
[уреди | уреди извор]- ^ Цорнелл, РМ; Сцхwертманн, У (2003). Тхе ирон оxидес: струцтуре, пропертиес, реацтионс, оццурренцес анд усес. Wилеy ВЦХ. ИСБН 978-3-527-30274-1.
- ^ Лавина, Барбара; Дера, Прземyслаw; Ким, Еуња; Менг, Yуе; Доwнс, Роберт Т.; Wецк, Пхилиппе Ф.; Суттон, Степхен Р.; Зхао, Yусхенг (2011). „Дисцоверy оф тхе рецоверабле хигх-прессуре ирон оxиде Фе4О5”. Процеедингс оф тхе Натионал Ацадемy оф Сциенцес. 108 (42): 17281—17285. Бибцоде:2011ПНАС..10817281Л. ПМЦ 3198347
 . ПМИД 21969537. дои:10.1073/пнас.1107573108
. ПМИД 21969537. дои:10.1073/пнас.1107573108  .
.
- ^ „Сyнтхесис оф Фе5О6”.
- ^ а б Бyкова, Е.; Дубровинскy, L.; Дубровинскаиа, Н.; Бyков, M.; МцЦаммон, C.; Овсyанников, С. V.; Лиерманн, Х. -П.; Купенко, I.; Цхумаков, А. I.; Рüффер, Р.; Ханфланд, M.; Пракапенка, V. (2016). „Струцтурал цомплеxитy оф симпле Фе2О3 ат хигх прессурес анд температурес”. Натуре Цоммуницатионс. 7: 10661. Бибцоде:2016НатЦо...710661Б. ПМЦ 4753252
 . ПМИД 26864300. дои:10.1038/нцоммс10661.
. ПМИД 26864300. дои:10.1038/нцоммс10661.
- ^ Мерлини, Марцо; Ханфланд, Мицхаел; Саламат, Асхкан; Петитгирард, Сyлваин; Мüллер, Харалд (2015). „Тхе црyстал струцтурес оф Мг2Фе2Ц4О13, wитх тетрахедраллy цоординатед царбон, анд Фе13О19, сyнтхесизед ат дееп мантле цондитионс”. Америцан Минералогист. 100 (8–9): 2001—2004. Бибцоде:2015АмМин.100.2001М. С2ЦИД 54496448. дои:10.2138/ам-2015-5369.
- ^ http://www.mindat.org/min-7281.html Миндат
- ^ Бретсцхгер, О.; Образтсова, А.; Стурм, C. А.; Цханг, I. С.; Горбy, Y. А.; Реед, С. Б.; Цуллеy, D. Е.; Реардон, C. L.; Баруа, С.; Ромине, M. Ф.; Зхоу, Ј.; Белиаев, А. С.; Боухенни, Р.; Саффарини, D.; Мансфелд, Ф.; Ким, Б.-Х.; Фредрицксон, Ј. К.; Неалсон, К. Х. (20. 7. 2007). „Цуррент Продуцтион анд Метал Оxиде Редуцтион бy Схеwанелла онеиденсис МР-1 Wилд Тyпе анд Мутантс”. Апплиед анд Енвиронментал Мицробиологy. 73 (21): 7003—7012. Бибцоде:2007АпЕнМ..73.7003Б. ПМЦ 2074945
 . ПМИД 17644630. дои:10.1128/АЕМ.01087-07.
. ПМИД 17644630. дои:10.1128/АЕМ.01087-07.






