Метил нитрат

| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.009.039 |
| |
| Својства | |
| CH3NO3 | |
| Моларна маса | 77,039 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Метил нитрат је метил естар азотне киселине и има хемијску формулу ЦХ3НО3. То је безбојна експлозивна испарљива течност.
Метил нитрат је такође и органско једињење, које садржи 1 атом угљеника и има молекулску масу од 77,039 Da.
Историја
[уреди | уреди извор]Метил нитрат није добио велику пажњу као експлозив, али је као мешавина која садржи 25% метанола коришћен као ракетно гориво и волуметријски експлозив под именом Мирол у нацистичкој Немачкој током Другог светског рата. Ова смеша би испаравала константном брзином и тако се њен састав не би мењао током времена. Представља благу експлозивну опасност (тешко га детонирати) и не детонира лако ударом.[3][4]
Према А. Стеттбацхеру, супстанца је коришћена као запаљива за време пожара у Рајхстагу 1933.[5] Гарц у једном недавном раду показује да само метил нитрат са својим потенцијалом производње и експлозије може представљати чувену и мистериозну „пуцајућу воду“ из немачки Феуерверкбуцх („књига о ватромету“) из око 1420.[6] (најстарији технички текст на немачком језику, написан руком у Дрездену, а касније штампан у Аугсбургу).[7]
Синтеза
[уреди | уреди извор]Може се произвести кондензацијом азотне киселине и метанола:[8]
- ЦХ3ОХ + ХНО3 → ЦХ3НО3 + Х2О
Новији метод користи метил јодид и сребрни нитрат:[9]
- ЦХ3I + АгНО3 → ЦХ3НО3 + АгИ
Метил нитрат се може произвести у лабораторијским или индустријским размерама или дестилацијом мешавине метанола и азотне киселине, или нитрацијом метанола мешавином сумпорне и азотне киселине. Први поступак није пожељан због велике опасности од експлозије коју представља пара метил нитрата. Други поступак је у суштини идентичан оном за прављење нитроглицерина. Међутим, процес се обично одвија на нешто вишој температури и мешавина се меша механички у индустријској скали уместо са компримованим ваздухом.
Експлозивна својства
[уреди | уреди извор]Метил нитрат је осетљив експлозив. Када се запали, гори изузетно жестоко сиво-плавим пламеном. Метил нитрат је веома јак експлозив, попут нитроглицерина, етилен гликол динитрата и других нитратних естара. Осетљивост метил нитрата на иницирање детонацијом је међу највећим познатим, са чак и капислом за експлозију број један, најнижом доступном снагом, која производи скоро пуну детонацију експлозива.
Упркос врхунским експлозивним својствима метил нитрата, он није добио примену као експлозив углавном због своје велике испарљивости, што спречава његово складиштење или безбедно руковање.
Особине
[уреди | уреди извор]| Особина | Вредност |
|---|---|
| Број акцептора водоника | 3 |
| Број донора водоника | 0 |
| Број ротационих веза | 1 |
| Партициони коефицијент[10] (ALogP) | 2,1 |
| Растворљивост[11] (logS, log(mol/L)) | -0,7 |
| Поларна површина[12] (PSA, Å2) | 55,0 |
Структура
[уреди | уреди извор]Експериментално је проучавана структура метил нитрата у гасној фази (комбинована дифракција гаса и електрона и микроталасна спектроскопија, ГЕД/МW) и у кристалном стању (дифракција рендгенских зрака, XРД) (видети табелу 1).[9]

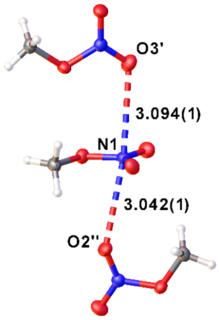
У чврстом стању постоје слабе интеракције између О и Н атома различитих молекула (види слику).
| XРД | ГЕД/МW | |
| Ц–О | 1.451(1) | 1.425(3) |
| Н–ОЦ | 1.388(1) | 1.403(2) |
| Н–Отерминал | 1.204(1) | 1.205(1) |
| Ц–О–Н | 113.3(1) | 113.6(3) |
| Отерминал-Н-Отерминал | 128.6(1) | 131.4(4) |
Карактеристике
[уреди | уреди извор]Метил нитрат је густине 1,21 г·цм-3[13]. То је безбојна течност јаког и ароматичног мириса, која брзо изазива јаке главобоље. Експлозиван је са мањом осетљивошћу на удар од нитроглицерина и његово испарљивостје много веће.
Експлозивна снага је слична нитроглицерину и желатинизује се санитроцелулозом, тако да је Алфред Нобел планирао да га користи, али никада није технички коришћен због његове нестабилности. Паре метил нитрата су изузетно експлозивне чак и без приступа ваздуху. У 19. веку, производња као међукорак за синтезу боја довела је до неколико катастрофалних експлозија (нпр. у Сен Денију, 1874). У отвореном контејнеру без претходног испаравања, метил нитрат тихо гори; када дође до паљења у епрувети,долази до експлозије без потребе за детонатором.
Неки важни параметри експлозије су следећи:[14]
- Енталпија експлозије: 6754 кЈ кг-1 (Х2О (л)) , 6055 кЈ · кг-1 (Х2О (г))
- Брзина детонације: 6300 мс-1 а при густини од 1,217 г · цм -3
- Запремина експлозивних гасова: 909 л кг-1
- Специфична енергија Тежина: 1301 кЈ кг-1
- Температура дефлаграције: брзо испаравање без паљења
- Траузл тест: 61 цм³ / 10 г
- Осетљивост на удар: 0,2 Нм
- Осетљивост на трење: до 353 Н Оптерећење пинова без икакве реакције
- Испитивање челичне чауре: Критични пречник 18 мм
Коришћење
[уреди | уреди извор]Упркос врхунским својствима експлозива метил нитрата, он није добио примену као експлозив углавном због своје велике испарљивости која спречава безбедно складиштење или руковање њиме.
Коришћен је као ракетно гориво у Немачкој током Другог светског рата, у мешавини која је садржала 25% метанола, названој „мирол“. Ова смеша испарава константном брзином тако да се њен састав не мења током времена.
Безбедност
[уреди | уреди извор]Осим што је експлозив, метил нитрат је токсичан и изазива главобоље када се удише.
Референце
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Meyer, Rudolf (2008). Explosivstoffe. Köhler, Josef., Homburg, Axel. (10., vollst. überarb. Aufl изд.). Weinheim: Wiley-VCH. ISBN 978-3-527-32009-7. OCLC 244068971.
- ^ Koch, Ernst-Christian (17. 6. 2019). Sprengstoffe, Treibmittel, Pyrotechnika. Walter de Gruyter GmbH & Co. KG (2. Auflage изд.). Berlin. ISBN 978-3-11-055784-8. OCLC 1107346317.
- ^ Stettbacher, A. (1948). Spreng- und Schießstoffe. Rascher Verlag, Zürich.
- ^ Gartz, Jochen (2007). Vom griechischen Feuer zum Dynamit : eine Kulturgeschichte der Explosivstoffe. Hamburg: E.S. Mittler & Sohn. ISBN 978-3-8132-0867-2. OCLC 153884719.
- ^ „www.feuerwerkbuch.de”. www.feuerwerkbuch.de. Приступљено 2020-06-15.
- ^ Black, A. P.; Babers, F. H. (1939). „Methyl nitrate”. Org. Synth. 19: 64.; Coll. Vol., 2, стр. 412
- ^ а б Reichel, Marco; Krumm, Burkhard; Vishnevskiy, Yury V.; Blomeyer, Sebastian; Schwabedissen, Jan; Stammler, Hans‐Georg; Karaghiosoff, Konstantin; Mitzel, Norbert W. (2019-12-16). „Solid‐State and Gas‐Phase Structures and Energetic Properties of the Dangerous Methyl and Fluoromethyl Nitrates”. Angewandte Chemie International Edition (на језику: енглески). 58 (51): 18557—18561. ISSN 1433-7851. PMC 6916544
 . PMID 31573130. doi:10.1002/anie.201911300
. PMID 31573130. doi:10.1002/anie.201911300  .
.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Салпетерсäуреестер ин: Роемпп Цхемие Леxикон, Тхиеме Верлаг, 2007, онлине.
- ^ Кöхлер, Ј.; Меyер, Р.; Хомбург, А.: Еxплосивстоффе, зехнте, воллстäндиг üберарбеитете Ауфлаге,, Wилеy-ВЦХ, Wеинхеим 2008, ИСБН 978-3-527-32009-7.
Литература
[уреди | уреди извор]- Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
