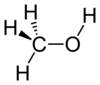
Метанол
| |||
| |||
| Називи | |||
|---|---|---|---|
| Преферисани IUPAC назив
Methanol[1] | |||
| Други називи
Карбинол
Колумбијски шпиритус хидроксиметан метил алкохол метил хидрат метил хидроксид метилни алкохол метилол пиролигниски шпиритус дрвени алкохол дрвени шпиритус | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| 3DMet | B01170 | ||
| Бајлштајн | 1098229 | ||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.599 | ||
| EC број | 200-659-6 | ||
| Гмелин Референца | 449 | ||
| KEGG[2] | |||
| MeSH | Methanol | ||
| RTECS | PC1400000 | ||
| UNII | |||
| UN број | 1230 | ||
| |||
| |||
| Својства | |||
| CH 3OH or CH 4O | |||
| Моларна маса | 32,04 g mol−1 | ||
| Агрегатно стање | Безбојна течност | ||
| Густина | 0,792 g/cm3[5] | ||
| Тачка топљења | −97,6 °C (−143,7 °F; 175,6 K) | ||
| Тачка кључања | 64,7 °C (148,5 °F; 337,8 K) | ||
| меша се | |||
| log P | −0,69 | ||
| Напон паре | 13,02 kPa (на 20 °C) | ||
| Киселост (pKa) | 15,5[6] | ||
| Конјугована киселина | Метилоксонијум[7] | ||
| Конјугована база | метанолат[8] | ||
| Магнетна сусцептибилност | −21,40·10−6 cm³/mol | ||
| Индекс рефракције (nD) | 1,33141[9] | ||
| Вискозност | 0,545 mPa·s (на 25 °C) [10] | ||
| Диполни момент | 1,69 D | ||
| Опасности[15][16] | |||
| Главне опасности | Умерено токсичан за мале животиње – високо токсичан за велике животиње и људе — може да буде фаталан/леталан или да узрокује слепило и да оштети јетру, бубреге, и срце ако се прогута – Токсични ефекти услед понављајућег прекомерног излатгања имају акумулативни ефекат на ЦНС, а посебно на оптички нерв – Симптоми могу да буду одложени, и да постану озбиљни након 12 до 18 сати, и да се задрже токон неколико дана након излагања [12] | ||
| Безбедност приликом руковања | [1] | ||
| ГХС пиктограми |    [11] [11]
| ||
| ГХС сигналне речи | Опасност [11] | ||
| H225, H301, H311, H331, H370[11] | |||
| P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P301+330+331, P310, P302+352[11] | |||
| NFPA 704 | |||
| Тачка паљења | 11 °C (52 °F; 284 K) | ||
| 470 °C (878 °F; 743 K)[18] 385 °C (725 °F; 658 K)[19] | |||
| Експлозивни лимити | 6–36%[13] | ||
| Смртоносна доза или концентрација (LD, LC): | |||
LD50 (средња доза)
|
5628 mg/kg (пацов, орално) 7300 mg/kg (миш, орално) 12880 mg/kg (пацов, орално) 14200 mg/kg (зец, орално)[14] | ||
LC50 (средња концетрација)
|
64.000 ppm (пацов, 4 h)[14] | ||
LCLo (најнижа објављена)
|
33.082 ppm (мачка, 6 h) 37.594 ppm (миш, 2 h)[14] | ||
| Границе изложености здравља у САД (NIOSH): | |||
PEL (дозвољено)
|
TWA 200 ppm (260 mg/m³)[13] | ||
REL (препоручено)
|
TWA 200 ppm (260 mg/m³) ST 250 ppm (325 mg/m³) [кожа][13] | ||
IDLH (тренутна опасност)
|
6000 ppm[13] | ||
| Сродна једињења | |||
Сродна
|
етанол бутанол | ||
Сродна једињења
|
метил-хлорид метоксиметан | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |||
| Референце инфокутије | |||
Метанол или метил алкохол (CH3OH), је први члан хомологог низа засићених монохидроксилних алкохола. Метанол је стекао назив дрвени алкохол јер се некад углавном производио путем деструктивне дестилације дрвета. У данашње време, метанол се углавном индустријски производи путем хидрогенације угљен моноксида.[20] Веома је отрован. Уколико се у мањим количинама унесе у организам доводи до слепила, а у већим до смрти.
То је најпростији алкохол, који се састоји од метил групе везане за хидроксилну групу. То је лака, испарљива, безбојна, запаљива течност са особеним задахом сличним етанолу (алкохолу за пиће).[21] Метанол је међутим далеко токсичнији од етанола. На собној температури, он је поларна течност. Са више од 20 милиона тона произведених годишње, он се користи као прекурсорза друге робне хемикалије, укључујући формалдехид, сирћетну киселину, метил терт-бутил етар, као и за низ других специјализованих хемикалија.[20]
Капацитети великих фабрика за производњу метанола се крећу од 200.000 до 310.000 тона годишње. Светска производња метанола је 2015. године износила 70 милиона тона са тенденцијом раста и тадашњим проценама да ће 2020. године износити око 100 милиона тона.
У Србији се метанол производи у Кикинди, фабрика МСК Кикинда (Метанолско-сирћетни комплекс Кикинда).
Заступљеност[уреди | уреди извор]
Мале количине метанола су присутне у нормалним, здравим људима. Једна студија је утврдила присуство од у просеку 4,5 ppm у издахнутом ваздуху испитаника.[22] Средња количина ендогеног метанола код људи од 0,45 g/дан може да буде метаболисана из пектина присутног у воћу; један килограм јабука производи до 1,4 g метанола.[23]
Метанол се природно производи при анаеробном метаболизму многих сојева бактерија и често је присутан у малим количинама у животној средини. Услед тога, атмосфера садржи мале количине метанолске паре. Атмосферски метанол бива оксидован у ваздуху под дејством сунчеве светлости до угљен-диоксида и воде током дана.
Међузвездана средина[уреди | уреди извор]
Метанол је присутан у великим количинама у регионима у којима се формирају звезде и користи се у астрономији као маркер таквих региона. Он се детектује помоћу његових спектралних емисионих линија.[24]
Астрономи су 2006. године, користећи низ радио телескопа MERLIN при Џодрел Банк опсерваторији, открили велики облак метанола у свемиру, широк 463 милиона km.[25][26] Године 2016, астрономи су детектовали метил алкохол у диску формирања планета око младе звезде TW Hydrae користећи ALMA радио телескоп.[27]
Отровност[уреди | уреди извор]
Удисањем ваздуха у коме има 3.000 ppm метанола током 8 сати неколико дана доводи до тешког тровања.[28] Смртна доза ингестијом износи 30 до 100 ml.[28] Метанол се у организму споро оксидује до CO и H2O те се због тога акумулира. Његови токсични метаболити су формалдехид, млечна и мравља киселина и ацетон чије дејство доводи до појаве специфичне симптоматологије тровања. Акутно тровање има три стадијума: пијанство, латенација (акумулација токсичних метаболита током 12-24 сата) и манифестовање тровања. Овај трећи стадијум карактеришу: запаљење слузокоже дисајних путева, поремећај вида, сметње од стране дигестивног тракта и грчеви мишића. Четвртог дана јављају се цијаноза, периферни колапс, конвулзије, кома, парализа центра за дисање са леталним (смртним) исходом у тежим случајевима.[28] Очна симптоматологија се састоји из: фотофобије, диплопије (дупло виђење), мидријазе, едема папиле и пролазно или трајног слепила.[28]
Метанол има ниску акутну токсичност код људи, али је опасан јер се заједно са етанолом повремено уноси у великим количинама. Мала количкина, као што је 10 mL (0,34 US fl oz) чистог метанола може да узрокује перманентно слепило путем деструкције видног живца. 30 mL (1,0 US fl oz) је потенцијално фатално.[29] Медијана леталне дозе је 100 mL (3,4 US fl oz) (i.e. 1–2 mL/kg телесне тежине чистог метанола[30]). Референтна доза за метанол је 2 mg/kg на дан.[31][32] Токсични ефекти почињу неколико сати након узимања, а антидоти често могу да спрече трајно оштећење.[29] Због његове сличности по изгледу и по мирису са етанолом (алкохолом у пићима), тешко је разликовати та два алкохола (као што је исто тако случај са денатурализованим алкохолом, фалсификованим пићима или алкохолним пићима врло ниског квалитета). Међутим, постоје случајеви отпорности на метанол, као што је случај Мајка Малоја који је био жртва неуспелог покушаја убиства метанолом почетком 1930-их.[33]
Особине[уреди | уреди извор]
| Особина | Вредност |
|---|---|
| Број акцептора водоника | 1 |
| Број донора водоника | 1 |
| Број ротационих веза | 0 |
| Партициони коефицијент[34] (ALogP) | -0,4 |
| Растворљивост[35] (logS, log(mol/L)) | 0,7 |
| Поларна површина[36] (PSA, Å2) | 20,2 |
Добијање метанола[уреди | уреди извор]
У индустрији, метанол се добија из синтетичког гаса, који је претходно добијен из метана. Наиме, метан је лако доступно једињење, будући да чини 70-90% природног гаса. Метан је непогодан за конверзију јер је релативно нереактивно једињење и подлеже реакцијама реформинга, као и хлоровања на високом притиску и температури. Најзначајнији поступак за конверзију метана у друга једињења је преко синтетичког гаса.
Синтетички гас[уреди | уреди извор]
Синтетички или водени гас представља смешу угљен-моноксида и водоника. Синтетички гас се добија реформингом паре, односно реакцијом метана и водене паре на температури од 900 °C у присуству никла као катализатора. Реакција се изводи у тубуларним реакторима, који су паковани са керамиком преко које је нанет катализатор. Реактор се загрева сагоревањем течног горива или самог гаса. Поред синтетичког гаса као сировина у реакцији реформинга се могу користити и лаке фракције нафте добијене дестилацијом.
У зависности од услова, одвијају се следеће хемијске реакције:
Прва и трећа реакција су, за разлику од друге, ендотермне и потребно је довести енергију да би дошло до реакције. Степен конверзије метана расте са повећањем температуре, повећањем парцијалног притиска водене паре и смањењем укупног притиска.
Метанол[уреди | уреди извор]
Метанол се добија конверзијом синтетичког гаса, егзотермном реакцијом:
Уколико се синтеза одвија помоћу синтетичког гаса добијеног из метана, онда се неповољан однос између водоника и угљен-моноксида (3:1) може компензовати додатком угљен-диоксида који реагује са водоником:
Равнотежа ових реакција се помера ка метанолу на нижим температурама и повишеном притиску. Као катализатор се раније користила смеша ZnO и Cr2O3 и притом се реакција изводи на температури од 350 °C и притиску од 340 bar. Време задржавања у реактору је врло краатко како би се спречило настајање споредних производа. Степен конверзије при једном проласку кроз катализатор је од 12 до 15%. Нови унапређен поступак производње користи активнији катализатор на бази бакра (CuO-ZnO-Cr2O3 или CuO-ZnO-Al2O3). Овакви катализатори омогућавају извођење реакције на нижим температурама од око 240 °C и нижим притисцима од 50 до 150 bar. Тако настаје метанол високе чистоће од 99,99 %.
Референце[уреди | уреди извор]
- ^ „Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 692. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- ^ Joanne Wixon; Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast. 17 (1): 48—55. doi:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ballinger, P.; Long, F. A. (1960). „Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds”. J. Am. Chem. Soc. 82 (4): 795—798. doi:10.1021/ja01489a008.
- ^ „Methyloxonium”. pubchem.ncbi.nlm.nih.gov (на језику: енглески). Приступљено 21. 12. 2018.
- ^ „Methanolate”. pubchem.ncbi.nlm.nih.gov (на језику: енглески). Приступљено 21. 12. 2018. „Methoxide is an organic anion that is the conjugate base of methanol. … It is a conjugate base of a methanol.”
- ^ „RefractiveIndex.INFO - Refractive index database”.
- ^ González, Begoña (2007). „Density, dynamic viscosity, and derived properties of binary mixtures of methanol or ethanol with water, ethyl acetate, and methyl acetate at T = (293.15, 298.15, and 303.15) K”. The Journal of Chemical Thermodynamics. 39 (12): 1578—1588. doi:10.1016/j.jct.2007.05.004.
- ^ а б в г „Methanol” (PDF). Lab Chem. Valtech. Архивирано из оригинала (PDF) 10. 03. 2016. г. Приступљено 10. 3. 2016.
- ^ Toxicity on PubChem
- ^ а б в г NIOSH Џепни водич хемијских хазарда. „#0397”. Nacionalni institut za bezbednost i zdravlje na radu (NIOSH).
- ^ а б в „Methanol”. Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ а б „The Emergency Response Safety and Health Database: Systematic Agent: METHANOL”. Centers for Disease Control and Prevention. Приступљено 3. 8. 2018.
- ^ „PubChem: Safety and Hazards - GHS Classification”. National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ „Methanol Safe Handling Manual” (PDF). Methanol Institute. 2017. стр. 253. Приступљено 3. 8. 2018.
- ^ „Technical Information & Safe Handling Guide for Methanol”. Methanex Corporation. Архивирано из оригинала 11. 3. 2012. г.
- ^ „Methanol Safe Handling Manual” (PDF). Methanol Institute. 2017. стр. 243. Приступљено 3. 8. 2018.
- ^ а б E. Fiedler; G. Grossmann; D. Burkhard Kersebohm; G. Weiss; C. Witte (2005). „Methanol”. Ullmann's Encyclopedia of Industrial Chemistry. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. ISBN 978-3527306732. doi:10.1002/14356007.a16_465.
- ^ National Institute for Occupational Safety and Health (22. 8. 2008). „The Emergency Response Safety and Health Database: Methanol”. Приступљено 17. 3. 2009.
- ^ Turner C (2006). „A longitudinal study of methanol in the exhaled breath of 30 healthy volunteers using selected ion flow tube mass spectrometry, SIFT-MS”. Physiological Measurement. 27 (7): 637—48. Bibcode:2006PhyM...27..637T. PMID 16705261. doi:10.1088/0967-3334/27/7/007.
- ^ Lindinger W (1997). „Endogenous production of methanol after the consumption of fruit”. Alcoholism, Clinical and Experimental Research. 21 (5): 939—43. PMID 9267548. doi:10.1111/j.1530-0277.1997.tb03862.x.
- ^ Brooks Hays (17. 4. 2015). „Why astronomers hate the lawn-mowing Roomba”. Space Daily.
- ^ „Upgraded MERLIN spies cloud of alcohol spanning 288 billion miles” (Саопштење). Jodrell Bank Centre for Astrophysics. 19. 4. 2006. Архивирано из оригинала 20. 7. 2011. г.
- ^ Amos, Jonathan (5. 4. 2006). „Merlin sees vast alcohol stream”. BBC News.
- ^ „First Detection of Methyl Alcohol in a Planet-forming Disc”. Приступљено 22. 6. 2016.
- ^ а б в г Шимон Ђармати, Хемија опасних материја, Виша политехничка школа, 2006.
- ^ а б A, Vale (2007). „Methanol”. Medicine. 35 (12): 633—4. PMID 26594941. doi:10.1016/j.mpmed.2007.09.014.
- ^ „Methanol Poisoning Overview”. Antizol. Архивирано из оригинала 5. 10. 2011. г.
- ^ „Integrated Risk Information System”. US EPA, ORD, NCEA, IRISD. Архивирано из оригинала 05. 12. 2012. г. Приступљено 11. 05. 2019.
- ^ „Toxicological Review of Methanol (Noncancer) (CAS No. 67-56-1) In Support of Summary Information on the Integrated Risk Information System (IRIS)” (PDF). EPA. септембар 2013. EPA/635/R-11/001Fa. Приступљено 4. 9. 2017.
- ^ Blum, Deborah (јануар 2011). The Poisoner's Handbook: Murder and the Birth of Forensic Medicine in Jazz Age New York. Penguin Books. стр. 231. ISBN 978-0-14-311882-4.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
Литература[уреди | уреди извор]
- Blum, Deborah (јануар 2011). The Poisoner's Handbook: Murder and the Birth of Forensic Medicine in Jazz Age New York. Penguin Books. стр. 231. ISBN 978-0-14-311882-4. Пронађени су сувишни параметри:
|pages=и|p=(помоћ)
- „Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. стр. 692. ISBN 978-0-85404-182-4. doi:10.1039/9781849733069-FP001.
- Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- Smith, Michael B.; March, Jerry (2007). Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th изд.). New York: Wiley-Interscience. ISBN 0-471-72091-7.
- Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
Спољашње везе[уреди | уреди извор]
- The Methanol Institute Industry trade group, lots of information on methanol's use in fuel cells and as an alternative fuel.
- Methyl Alcohol (Methanol) CDC/NIOSH, links to safety information
- CDC – NIOSH Pocket Guide to Chemical Hazards – Methyl Alcohol