Rastvor


Rastvori predstavljaju složene dvokomponentne ili višekomponentne sisteme za koje se može reći da su disperzni sistemi sastavljeni od dispergovane faze ili rastvorene supstance i disperzionog sredstva ili rastvarača.[1][2] Većina analitičkih reakcija se odvija u rastvorima pri čemu se najčešće koriste sistemi gde je dispergovana faza čvrsta supstanca, a disperziono sredstvo tečnost, uglavnom voda. Rastvori mogu biti u gasovitom (vazduh), tečnom (sve tečnosti) i u čvrstom agregatnom stanju (legure - čelik, bronza, mesing...) Rastvor u užem smislu je samo tečni rastvor, prevashodno onaj nastao rastvaranjem čvrste materije u rastvaraču.[3]
U zavisnosti od veličina čestice dispergovane faze, disperzni sistemi se mogu podeliti na:
- Prave rastvore (manja od 1 nm)
- Koloidne rastvore (od 1-1000 nm)
- Suspenzije (>1000 nm)
Po količini rastvorene supstance rastvori mogu biti: nezasićeni (<R), zasićeni (R), i prezasićeni (>R). Rastvorljivost supstance se izražava kao masa supstance koja se rastvara u 100 g rastvarača na datoj temperaturi. Rastvorljivost za supstancu A se označava kao R(A).
Rastvarač i rastvor
[uredi | uredi izvor]Osnovno je svojstvo svih pravih rastvora homogen sastav, što znači da npr. rastvor etanola u vodi u svakom svom delu ima jednak sastav, odnosno da je svuda u rastvoru odnos broja molekula etanola i vode stalan. U rastvorima se pravi razlika između rastvarača i rastvor. Ako su rastvarač i rastvorak tečnosti, rastvaračem se najčešće naziva onaj sastojak koga u rastvoru ima više. Inače, pod rastvaračem se podrazumeva tečnost, a pod rastvorkom čvrsta ili gasovita materija koja se u toj tečnosti rastvara.
Vrste rastvora
[uredi | uredi izvor]
Tečne materije (tečnosti) se često mogu među sobom rastvarati (mešati) potpuno (u svim odnosima) ili u ograničenoj meri. Rastvorljivost tečnosti koje se ne mešaju u svim odnosima redovno se menja s temperaturom, te na određenoj temperaturi može postati potpuna (kritična tačka rastvorljivosti).
Čvrste se materije obično rastvaraju u rastvaračima u ograničenoj meri. Najveća količina čvrste materije koja se pod danim uslovima (ponajprije pri određenoj temperaturi) može rastvoriti u određenoj količini rastvarača naziva se rastvorljivost te materije pod tim uslovima.
Rastvori mogu biti zasićeni i nezasićeni.
Zasićeni rastvor je onaj rastvor koji sadrži maksimalnu količinu rastvorene supstance na određenoj temperaturi i koji se nalazi u stanju dinamičke ravnoteže sa viškom čvrste supstance.
Nezasićeni rastvor je rastvor koji sadrži manju količinu rastvorene supstance nego što to odgovara rastvorljivosti te supstance na datoj temperaturi. Onaj koji sadrži nešto manje, ali još uvek velike količine rastvorene materije naziva se koncentrovanim, a onaj koji sadrži male količine rastvorka je razređeni rastvor. Koncentrovani i razređeni rastvor spadaju u nezasićene rastvore. U nekim je uslovima moguće da rastvor sadrži više rastvorka nego što bi odgovaralo rastvorljivosti, te se tada govori o prezasićenom rastvoru.
Rastvor gasa u tečnosti načelno se ne razlikuje od smeše tečnosti; zakon linearne zavisnosti napona pare razređenog rastvora od koncentracije naziva se u tom slučaju Henrijevim zakonom.[4][5]
Vrste rastvora prema veličini čestica
[uredi | uredi izvor]
Svi rastvori u kojima je ratvarač tečnost (voda) mogu se podeliti u tri disperzna sistema prema rastvorenim ili raspršenim česticama:[6]
| Naziv sistema | Veličina čestica | Primer |
|---|---|---|
| Suspenzija | > 1000 nm | mutna rečna voda |
| Koloidni rastvor | 1 - 1000 nm[7] | mleko, citoplazma |
| Pravi rastvor | <1 nm | morska voda, vino |
Koloidi su mešavina dve ili više faza u kojima najmanje jedna faza ima dimenzije od 1 nm i 1 mikrometra.[8] Koloidne čestice se ne mogu odvojiti od rastvora filtriranjem jer su premale i prolaze kroz filter papir.
Koloid: Kratak sinonim za koloidni sistem.[9][10]
Koloidan: Stanje potpodele u kome molekuli ili molekularne čestice dispergovane u medijumu imaju bar jednu dimenziju između približno 1 nm i 1 μm, ili da su u sistemu diskontinuiteti prisutni na udaljenostima tog reda veličine.[9][10][11]
Ove čestice se ne talože već lebde u rastvoru.
Koloidne čestice mogu biti čvrste, tečne i gasovite. Dele se na:
- Sol disperzije - čvrste čestice u tečnosti.
- Emulzija - disperzije tečnosti u tečnosti.[12][13]
- Gel koagulirani oblik - koji ima sojstva čvrstog stanja a sastoji se iz čvrste i tečne faze.
- Aerosol - disperzije čvrstih ili tečnih čestica u gasu.[14][15]
- Pena - disperzija gasova u tečnostima ili čvrstim supstancama.[16][17][18]
Kvantitativno izražavanje sastava rastvora
[uredi | uredi izvor]Kvantitativni sastav rastvora možemo izraziti kao:
- Udeo, predstavlja odnos neke veličine (mase, količine ili zapremine) jedne komponente prema toj veličini za smešu svih komponenata.
- Koncentracija, pokazuje koliko se puta neka od veličina nalazi u zapremini od 1 dm³.
- Titar, predstavlja posebno izraženu masenu koncentraciju koja je rastvorena u 1 cm³ rastvora.
- Ppm
- Ppb
- Masena koncentracija predstavlja masu supstance u jediničnoj zapremini rastvora.
- Količinska koncentracija predstavlja količinu supstance u jediničnoj zapremini.
- T=M/V (cm³)
P-funkcija se koristi za izračunavanje koncentracije razblaženih rastvora i definisana je kao negativni logaritam za osnovu 10 koncentracije određene supstance.
Aktivnost
[uredi | uredi izvor]Izvođenjem eksperimenata, utvrđeno je da je izuzev u razblaženim rastvorima efektivna koncentracija jona manja od stvarne koncentracije. Uzrok ove pojave se objašnjava činjenicom da u rastvorima elektrolita dolazi do jonskih interakcija koje su posledica postojanja elektrostatičkih sila. Razblaženi rastvori u kojima je interakcija između čestica zanemarljiva, ponašaju se kao idealni rastvori dok je odstupanje veće ako je rastvor koncentrovaniji.
Da bi se napravila razlika između efektivne i stvarne koncentracije, Luis uvodi pojam aktivnosti. Aktivnost (a) je delotvorna koncentracija neke supstance u rastvorima elektrolita. Aktivnost jona u rastvoru elektrolita je relativna vrednost jer nam pokazuje koliko je jon aktivan u odnosu na referentni rastvor u kome je koncentracija 1 mol/dm³.
- a = f*c/c0 = f*c[19]
Rastvorljivost materije u rastvaračima
[uredi | uredi izvor]Voda je uobičajen ali istovremeno vrlo osoben rastvarač. Molekuli vode su dipoli među kojima deluju vodonične veze te je voda veoma polaran rastvarač. Drugi rastvarači mogu da budu polarni (alkoholi), slabo polarni (etri) ili nepolarni (ugljovodonici). U vodi se zato dobro rastvaraju polarne odnosno jonske materije, građene od naelektrisanih čestica jona, a to su razne soli, kiseline, hidroksidi, dok se nepolarne materije (jod, sumpor) ne rastvaraju ili ne mešaju (ugljovodonici, ulja). Suprotno tome u nepolarnim ili slabo polarnim rastvaračima (ugljovodonici, etri) slabo se rastvaraju jonske materije a dobro se rastvaraju nepolarne kovalentne materije (ulja, masti). Zato je postavljeno „zlatno pravilo” rastvaranja: „Slično se otapa u sličnom.”[6] Takođe uopšteno važi: rastvorljivost čvrstih materija raste sa porastom temperature rastvarača, dok rastvorljivost gasova opada.
Rastvorljivost materije u vodi
[uredi | uredi izvor]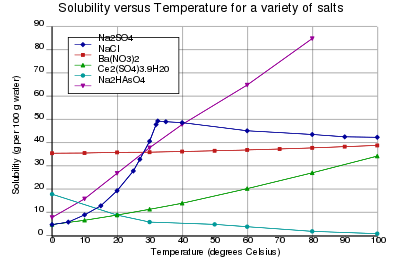
Rastvorljivost materije u vodi je značajno svojstvo materije. Ona se izražava u gramima rastvorene materije tvari na 100 g vode pri datoj temperaturi. Rastvorljivost može za različite materije biti vrlo različita (nerastvorne, slabo rastvorne, jako rastvorne materije), a redovno se menja sa temperaturom: sa porastom temperature najčešće se povećava, ali se može i smanjivati, ili se u jednom temperaturnom intervalu povećavati, a u drugome smanjivati (dijagram).
Svojstva rastvora
[uredi | uredi izvor]Svojstva rastvora (npr. gustina, vrelište) linearno se menjaju s njenim sastavom samo onda kada su sastojci među sobom hemijski srodni, npr. u smešama ugljovodonika (idealni rastvori). U protivnom, postoje redovno znatna odstupanja od linearnosti (npr. neke smese tečnosti vru na temperaturi nižoj ili višoj od vrelišta bilo kojeg od njihovih sastojaka). Tada linearna zavisnost od sastava postoji samo za razređene rastvore. S povećanjem koncentracije rastvora materije smanjuje se pritisak para rastvarača, što kao posledicu ima sniženje temperature očvršćivanja i povišenje temperature vrelišta rastvora. Ova dva svojstva rastvora zajedno sa osmozom se ubrajaju u koligativna svojstva rastvora.[20] To su svojstva koja zavise jedino od broja rastvorenih čestica, a ne i o njihove hemijske ili fizičke prirode.[3]
Reference
[uredi | uredi izvor]- ^ IUPAC. „solution”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ a b Rastvor, Leksikografski zavod Miroslav Krleža, Hrvatska enciklopedija
- ^ Henry, W. (1803). „Experiments on the quantity of gases absorbed by water, at different temperatures, and under different pressures”. Phil. Trans. R. Soc. Lond. 93: 29—274. doi:10.1098/rstl.1803.0004.
- ^ Sander, R. (2015), „Compilation of Henry's law constants (version 4.0) for water as solvent”, Atmos. Chem. Phys., 15 (8): 4399—4981, Bibcode:2015ACP....15.4399S, doi:10.5194/acp-15-4399-2015

- ^ a b Habuš, Strićević, Liber: Opća kemija 2, Udžbenik kemije, 2. izd., Profil, Zagreb. 2008. ISBN 978-953-12-0390-6. стр. 30-42.
- ^ Levine 2001, стр. 955.
- ^ „Colloid”. Britannica Online Encyclopedia. Приступљено 31. 8. 2009.
- ^ а б Jones, Richard G.; Wilks, Edward S.; Metanomski, W. Val; Kahovec, Jaroslav; Hess, Michael; Stepto, Robert; Kitayama, Tatsuki, ур. (2009). Compendium of Polymer Terminology and Nomenclature (IUPAC Recommendations 2008) (2nd изд.). RSC Publ. стр. 464. ISBN 978-0-85404-491-7.
- ^ а б Stepto, Robert F. T. (2009). „Dispersity in polymer science (IUPAC Recommendations 2009)” (PDF). Pure and Applied Chemistry. 81 (2): 351—353. doi:10.1351/PAC-REC-08-05-02.
- ^ Slomkowski, Stanislaw; Alemán, José V.; Gilbert, Robert G.; Hess, Michael; Horie, Kazuyuki; Jones, Richard G.; Kubisa, Przemyslaw; Meisel, Ingrid; Mormann, Werner; Penczek, Stanisław; Stepto, Robert F. T. (2011). „Terminology of polymers
and polymerization processes in dispersed systems (IUPAC Recommendations 2011)”. Pure and Applied Chemistry. 83 (12): 2229—2259. doi:10.1351/PAC-REC-10-06-03. - ^ Kumar, Harish V.; Woltornist, Steven J.; Adamson, Douglas H. (1. 3. 2016). „Fractionation and characterization of graphene oxide by oxidation extent through emulsion stabilization”. Carbon. 98: 491—495. doi:10.1016/j.carbon.2015.10.083.
- ^ Khan, A. Y.; Talegaonkar, S; Iqbal, Z; Ahmed, F. J.; Khar, R. K. (2006). „Multiple emulsions: An overview”. Current Drug Delivery. 3 (4): 429—43. PMID 17076645. doi:10.2174/156720106778559056.
- ^ DeCarlo, P. F. (2004). „Particle Morphology and Density Characterization by Combined Mobility and Aerodynamic Diameter Measurements. Part 1: Theory”. Aerosol Science & Technology. 38 (12). Bibcode:2004AerST..38.1185D. doi:10.1080/027868290903907.
- ^ Jillavenkatesa, A; Dapkunas, SJ; Lin-Sien, Lum (2001). „Particle Size Characterization”. NIST Special Publication. 960-1.
- ^ Miloš B. Rajković (2007)˝Uvod u analitičku hemiju klasične osnove˝, Beograd, Str. 11-33
- ^ D. Weaire; S. Hutzler (1999). The Physics of Foams. Oxford University Press. ISBN 978-0-19-851097-0.
- ^ I. Cantat, S. Cohen-Addad, F. Elias, F. Graner, R. Höhler, O. Pitois, F. Rouyer, A. Saint-Jalmes, "Foams: structure and dynamics", Oxford University Press, ed. S.J. Cox. 2013. ISBN 9780199662890.
- ^ Rastvori
- ^ McQuarrie, Donald, et al. Colligative properties of Solutions" General Chemistry Mill Valley: Library of Congress. 2011. ISBN 978-1-89138-960-3.
Literatura
[uredi | uredi izvor]- Jones, Richard G.; Wilks, Edward S.; Metanomski, W. Val; Kahovec, Jaroslav; Hess, Michael; Stepto, Robert; Kitayama, Tatsuki, ur. (2009). Compendium of Polymer Terminology and Nomenclature (IUPAC Recommendations 2008) (2nd izd.). RSC Publ. str. 464. ISBN 978-0-85404-491-7.
- IUPAC. „solution”. Kompendijum hemijske terminologije (Internet izdanje).
- Lyklema, J. Fundamentals of Interface and Colloid Science, Vol. 2, p. 3208, 1995
- Rodil, Ma. Lourdes C. (1997). Chemistry The Central Science (7th izd.). ISBN 978-0-13-533480-5.
- Darragh, P.J., et al., Scientific American, Vol. 234, p. 84, (1976)
- Luck, W. et al., Ber. Busenges Phys. Chem., Vol. 67, p. 84 (1963);
- Hiltner, P.A. and Krieger, I.M., Diffraction of Light by Ordered Suspensions, J. Phys. Chem., Vol. 73, p. 2306 (1969)
- Arora, A.K., Tata, B.V.R., Eds. Ordering & Phase Transitions in Charged Colloids Wiley, New York (1996)
- Sood, A.K. in Solid State Physics, Eds. Ehrenreich, H., Turnbull, D., Vol. 45, p. 1 (1991)
- Sherman, Philip (1963). Rheology of emulsions: proceedings of a symposium held by the British Society of Rheology ... Harrogate, October 1962. British Society of Rheology. Macmillan.
- Handbook of Nanostructured Materials and Nanotechnology; Nalwa, H.S., Ed.; Academic Press: New York, NY, USA, 2000; Volume 5, pp. 501–575
- Colbeck, Ian; Lazaridis, Mihalis, ur. (2014). Aerosol Science: Technology and Applications. John Wiley & Sons - Science. ISBN 978-1-119-97792-6.
- Hinds, William C. (1999). Aerosol Technology (2nd izd.). Wiley - Interscience. ISBN 978-0-471-19410-1.
- Lucassen, J. (1981). Lucassen-Reijnders, E. H., ur. Anionic Surfactants – Physical Chemistry of Surfactant Action. NY, USA: Marcel Dekker.
- Pruppacher, H. R.; Klett, J. D. Microphysics of Clouds and Precipitation (2nd izd.). Springer. ISBN 978-0-7923-4409-4.
- Seinfeld, John; Pandis, Spyros (1998). Atmospheric Chemistry and Physics: From Air Pollution to Climate Change (2nd izd.). Hoboken, New Jersey: John Wiley & Sons, Inc. ISBN 978-0-471-17816-3.
