Спинална мишићна атрофија
| Спинална мишићна атрофија | |
|---|---|
| Синоним | Аутозомно рецесивна проксимална спинална мишићна атрофија, 5к спинална мишићна атрофија |
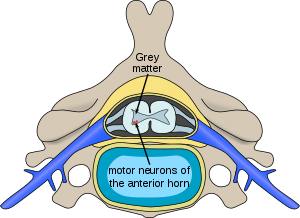 | |
| Локација неурона захваћених спиналном мишићном атрофијом у кичменој мождини. | |
| Специјалности | Неурологија |
| Симптоми | Сколиоза, контрактуре зглобова, пнеумонија |
| Компликације | Сколиоза, контрактура зглобова, пнеумонија |
| Типови | Типови 1-4[1] |
| Узроци | Мутација у SMN1 гену |
| Слична обољења | Конгенитална мишићна дистрофија, Дученеова мишићна дистрофија, Прадер-Вили синдром[1] |
| Лечење | Подржавање, лекови[2] |
| Лекови | Нусинерсен, Рисдиплам |
| Фреквенција | 1 на 4.000 порођаја до око 1. на 16.000 порођаја, са 1 од 7.000 и 1 на 10.000 који се обично наводе за Европу и САД |
Спинална мишићна атрофија (СМА) је редак[3] неуромишићни поремећај који доводи до губитка моторних неурона и прогресивног губитка мишића.[4][5][6] Обично се дијагностикује у детињству или раном детињству и ако се не лечи, најчешћи је генетски узрок смрти новорођенчади.[7] Такође се може појавити касније у животу и тада имати блажи ток болести. Заједничка карактеристика је прогресивна слабост вољних мишића, при чему су први захваћени мишићи руку, ногу и дисајних органа.[8][9] Повезани проблеми могу укључивати лошу контролу главе, тешкоће при гутању, сколиозу и контрактуре зглобова.[1][9]
Старост почетка и озбиљност симптома чине основу традиционалне класификације спиналне мишићне атрофије у неколико типова.[7]
Спинална мишићна атрофија је последица абнормалности (мутације) у СМН1 гену који кодира СМН, протеин неопходан за преживљавање моторних неурона.[2] Губитак ових неурона у кичменој мождини спречава сигнализацију између мозга и скелетних мишића.[2] Други ген, СМН2, сматра се геном који модификује болест, јер обично што се СМН2 више копира, то је ток болести блажи. Дијагноза СМА се заснива на симптомима и потврђује се генетским тестирањем.[10]
Обично се мутација у СМН1 гену наслеђује од оба родитеља на аутозомно рецесиван начин, иако се у око 2% случајева јавља током раног развоја (де ново).[11] Инциденца спиналне мишићне атрофије широм света варира од око 1 на 4.000 порођаја до око 1. на 16.000 порођаја,[12] са 1 од 7.000 и 1 на 10.000 који се обично наводе за Европу и САД.[13]
Исходи у природном току болести варирају од смрти у року од неколико недеља након рођења у најакутнијим случајевима до нормалног животног века код продужених облика СМА.[9] Увођење каузативних третмана у 2016. значајно је побољшало исходе. Лекови који циљају на генетски узрок болести укључују нусинерсен, рисдиплам и лек за генску терапију онасемноген абепарвовец. Подржавајућа нега обухвата физикалну терапију, радну терапију, респираторну подршку, нутритивну подршку, ортопедске интервенције и подршку мобилности.[4]
Класификација
[уреди | уреди извор]5q СМА је појединачна болест која се манифестује у широком распону тежине, погађајући одојчад преко одраслих. Пре него што је схваћена његова генетика, сматрало се да су њене различите манифестације различите болести – Вердниг-Хофманнова болест када су била погођена мала деца и Кугелберг-Веландерова болест за случајеве са касним почетком.[14]
Године 1990. уочено је да ове одвојене болести чине спектар истог поремећаја. Спинална мишићна атрофија је затим класификована у 3-5 клиничких типова на основу старости појаве симптома или максималне постигнуте моторичке функције.[11] Тренутно, консензус је да фенотип спиналне мишићне атрофије обухвата континуум симптома без јасног разграничења подтипова.[11] Међутим, традиционална класификација, приказана у табели испод, и данас се користи како у клиничким истраживањима, тако и понекад, контроверзно, као критеријум приступа терапијама.
| Тип | Епоним | Уобичајена старост почетка | Природна историја (без фармаколошког третмана) | OMIM |
|---|---|---|---|---|
| СМА 0 | Пренатално | Симптоми се примећују при рођењу и често постају очигледни у пренаталном периоду као смањено кретање фетуса. Погођена деца обично имају само једну копију SMN2 гена и обично преживе само неколико недеља чак и уз респираторну подршку 24/7. Овај облик је веома редак – заузима око 2% случајева. | ||
| СМА 1(инфанција) | Вердниг-Хофманова болест | 0–6 месециs | Овај облик се дијагностикује код око 50% пацијената, код којих се болест манифестује у првих неколико недеља или месеци живота. СМА тада има брз и неочекиван почетак, са различитим мишићним групама прогресивно. Бебе никада не науче да седе без ослонца и постепено губе већину мишићне функције. Смрт је обично узрокована затајењем респираторних мишића изазвано упалом плућа (често, аспирациона пнеумонија). Осим ако се рано не пружи респираторна подршка и/или фармаколошки третман, бебе са дијагнозом СМА типа 1 генерално не преживе после две године. Уз одговарајућу респираторну подршку, познато је да они са блажим фенотиповима СМА типа 1, који чине око 10% случајева СМА 1, преживљавају у адолесценцији и одраслој доби чак и без фармаколошког третмана, иако им је увек потребна нега 24 сата дневно. | Online Mendelovsko nasleđivanje kod čoveka (OMIM) 253300 |
| СМА 2(средња инфанција) | Дубовицова болест | 6–18 месеци | Средњи облик, дијагностикован код око 20% пацијената, означава људе који су били у стању да задрже седећи положај барем неко време у свом животу, али никада нису научили да ходају без подршке. Почетак слабости се обично примећује у периоду између 6 и 18 месеци живота. Познато је да напредак увелико варира, неки људи постепено слабе током времена, док други кроз пажљиво одржавање остају релативно стабилни. Мишићи тела су ослабљени, а респираторни систем је главна брига, као и контрактуре мишића и закривљеност кичме. Очекивани животни век је смањен, чак и када већина људи са СМА 2 живи дуго у одраслом добу чак и без лечења. | Online Mendelovsko nasleđivanje kod čoveka (OMIM) 253550 |
| СМА 3(јувенилно) | Кугелберг-Веландерова болест | >12 месеци | Јувенилни облик, који се дијагностикује код око 30% пацијената, манифестује се после 12 месеци живота или након што су деца већ научила да направе бар неколико самосталних корака. Болест напредује споро, а већина људи са СМА 3 губи способност ходања некада у животу, што захтева подршку при кретању. Респираторно захваћеност је ретка и очекивани животни век је нормалан или скоро нормалан. | Online Mendelovsko nasleđivanje kod čoveka (OMIM) 253400 |
| СМА 4(одрасло доба) | Одрасло доба | Ово означава форму са почетком у одраслом добу, понекад такође класификовану као СМА типа 3 са касним почетком. Јавља се у приближно 5% пацијената и обично се манифестује у трећој или четвртој деценији живота. Симптоми се састоје од постепеног слабљења мишића ногу, због чега је често неопходно да пацијент користи помагала за ходање. Остале компликације су ретке и очекивани животни век је непромењен. | Online Mendelovsko nasleđivanje kod čoveka (OMIM) 271150 |

Симптоми
[уреди | уреди извор]Симптоми варирају у зависности од типа СМА, стадијума болести као и појединачних фактора. Доле наведени знаци и симптоми су најчешћи код тешког СМА типа 0/I:[15]
- Арефлексија, посебно у екстремитетима
- Свеукупна слабост мишића, слаб тонус мишића, млохавост или склоност падању
- Потешкоће у постизању развојних прекретница, тешкоће седења/стојања/ходања
- Код мале деце: усвајање положаја жабље ногице при седењу (кукови абдуцирани и савијена колена)
- Губитак снаге респираторних мишића: слаб кашаљ, слаб плач (одојчад), накупљање секрета у плућима или грлу, респираторни дистрес
- Торзо у облику звона (узрокован коришћењем само трбушних мишића за дисање) код тешког типа СМА
- Фасцикулације (трзање) језика
- Потешкоће у сисању или гутању, лоше храњење
Узроци
[уреди | уреди извор]
Спинална мишићна атрофија је узрокована генетском мутацијом у SMN1 гену.[16]
Људски хромозом 5 садржи два скоро идентична гена на локацији 5q13: теломерну копију SMN1 и центромерну копију SMN2. Код здравих особа, ген SMN1 кодира опстанак протеина моторних неурона (SMN) који, како му име каже, игра кључну улогу у опстанку моторних неурона. SMN2 ген, с друге стране – због варијације у једном нуклеотиду (840.C→T) – пролази кроз алтернативно спајање на споју интрона 6 са ексоном 8, при чему само 10–20% SMN2 транскрипата кодира потпуно функционално преживљавање протеина моторних неурона (SMN-fl) и 80–90% транскрипата што резултира скраћеним протеинским једињењем (SMNΔ7) које се брзо разграђује у ћелији.[17]
Код појединаца захваћених СМА, SMN1 ген је мутиран на такав начин да није у стању да исправно кодира SMN протеин – било због делеције[18] која се дешава на егзону 7[19] или због других тачака мутација (често што доводи до функционална конверзија SMN1 секвенце у SMN2). Скоро сви људи, међутим, имају најмање једну функционалну копију SMN2 гена (од којих већина има 2-4) која и даље кодира 10-20% уобичајеног нивоа SMN протеина, омогућавајући неким неуронима да преживе. Дугорочно, међутим, смањена доступност SMN протеина резултира постепеном смрћу ћелија моторних неурона у предњем рогу кичмене мождине и мозгу. Скелетни мишићи, који сви зависе од ових моторних неурона за неуронски унос, сада имају смањену инервацију (која се назива и денервација) и стога имају смањен улаз из централног нервног система (ЦНС). Смањен пренос импулса кроз моторне неуроне доводи до смањене контрактилне активности денервираног мишића. Сходно томе, денервисани мишићи пролазе кроз прогресивну атрофију (отпад).
Обично су први захваћени мишићи доњих екстремитета, затим мишићи горњих екстремитета, кичме и врата и, у тежим случајевима, плућни и жвачни мишићи. Проксимални мишићи су увек захваћени раније и у већој мери него дистални мишићи.[20]
Озбиљност симптома СМА је у великој мери повезана са тим колико добро преостали SMN2 гени могу надокнадити губитак функције SMN1. Ово делимично зависи од броја копија SMN2 гена присутног на хромозому. Док здраве особе обично носе две копије гена SMN2, особе са СМА могу имати било шта између 1 и 5 (или више) њих; што је већи број SMN2 копија, то је блажа тежина болести. Дакле, већина беба СМА типа 1 има једну или две SMN2 копије; особе са СМА 2 и 3 обично имају најмање три SMN2 копије; а особе са СМА 4 нормално имају најмање четири. Међутим, корелација између тежине симптома и броја копија SMN2 није апсолутна и изгледа да постоје други фактори који утичу на фенотип болести.[21]
Спинална мишићна атрофија се наслеђује аутозомно рецесивно, што значи да се дефектни ген налази на аутозому. Две копије дефектног гена – по једна од сваког родитеља – су потребне да би се наследио поремећај: родитељи могу бити носиоци и нису лично погођени. Чини се да се СМА појављује де ново (тј. без икаквих наследних узрока) у око 2–4% случајева.
Спинална мишићна атрофија погађа појединце свих етничких група, за разлику од других добро познатих аутозомно рецесивних поремећаја, као што су болест српастих ћелија и цистична фиброза, који имају значајне разлике у стопи појављивања међу етничким групама. Укупна преваленција СМА, свих типова и међу свим етничким групама, је у распону од 1 на 10.000 особа; фреквенција гена је око 1:100, дакле, отприлике једна од 50 особа је носилац.[22][23]
Дијагноза
[уреди | уреди извор]СМА се дијагностикује коришћењем генетског тестирања које открива хомозиготну делецију SMN1 гена у преко 95% случајева и мутацију једињења SMN1 код преосталих пацијената. Генетско тестирање се обично спроводи уз помоћ узорка крви, а МЛПА је једна од чешће коришћених техника генетског тестирања, јер такође омогућава утврђивање броја копија гена SMN2, што има клинички значај.[24]
Рана дијагноза
[уреди | уреди извор]Рана дијагноза СМА, у асимптоматској фази болести, омогућава:
- Преимплантацијско тестирање
- Преимплантациона генетска дијагноза се може користити за скрининг ембриона захваћених СМА током вантелесне оплодње.
- Пренатално тестирање
- Пренатално тестирање на СМА могуће је путем узорковања хорионских ресица, феталне ДНК анализе без ћелија и другим методама.
- Скрининг новорођенчета
Рутински скрининг новорођенчади на СМА постаје све уобичајенији у развијеним земљама, с обзиром на доступност узрочних третмана који су најефикаснији у асимптоматском стадијуму болести.[25][26] У 2018. години, скрининг новорођенчади на СМА је додат на листу препоручених скрининг тестова новорођенчади у САД[27][28] и од априла 2020. усвојен је у 39 америчких држава.[27] Од маја 2021. године, СМА скрининг новорођенчади је примењен на Тајвану[29] и у току је у примени у Аустралији,[30] Белгији,[31] Канади, Француској, Немачкој,[32] Холандији,[33] Пољској, Србији и Словенији. Поред тога, пилот пројекти се спроводе у Аустралији, Кини,[34] Италији и Јапану.[35]
Тестирање носиоца
[уреди | уреди извор]Они који су у опасности да буду носиоци делеције SMN1, а самим тим и под ризиком да имају потомство захваћено СМА, могу се подвргнути анализи носиоца користећи узорак крви или пљувачке. Амерички колеџ акушера и гинеколога препоручује да се све особе које размишљају о трудноћи тестирају да би се видело да ли су носиоци болести.[36] Учесталост носиоца СМА је упоредива са другим поремећајима као што је таласемија, а у кохорти северне Индије утврђено је да је 1 од 38.[37] Међутим, генетско тестирање неће моћи да идентификује све појединце у ризику, јер је око 2% случајева узроковано де ново мутацијама, а 5% нормалне популације има две копије SMN1 на истом хромозому, што омогућава да буде носилац тако што има један хромозом са две копије и други хромозом са нула копија. Ова ситуација ће довести до лажно негативног резултата, пошто статус носиоца неће бити исправно откривен традиционалним генетским тестом.[38][39]
Лечење
[уреди | уреди извор]Лекови
[уреди | уреди извор]Нусинерсен (на тржишту као Спинраза) се користи за лечење спиналне мишићне атрофије.[40] То је антисенс нуклеотид који модификује алтернативно спајање СМН2 гена.[41] Даје се директно централном нервном систему помоћу интратекалне инјекције.[41] Нусинерсен продужава преживљавање и побољшава моторичку функцију код новорођенчади са СМА.[42] Одобрен је за употребу у САД 2016. године, а за употребу у ЕУ 2017. године.[43][44]
Золгенсма је третман генске терапије који користи самокомплементарни адено-повезани вирус типа 9 (scAAV-9) као вектор за испоруку СМН1 трансгена.[45][46] Терапија је први пут одобрена у САД у мају 2019. као интравенска формулација за децу млађу од 24 месеца. Уследило је одобрење у Европској унији, Јапану и другим земљама, иако често са различитим обимима одобрења.[47]
Рисдиплам је лек који се узима орално у течном облику.[48] То је дериват пиридазина који делује тако што повећава количину функционалног преживелог протеина моторног неурона који производи СМН2 ген кроз модификацију његовог обрасца спајања.[49] Рисдиплам је први пут одобрен за медицинску употребу у Сједињеним Државама у августу 2020. године[50] и од тада је одобрен у преко 30 земаља.
Дисање
[уреди | уреди извор]Респираторни систем је најчешћи систем који је захваћен и компликације су водећи узрок смрти код СМА типова 0/1 и 2. СМА тип 3 може имати сличне респираторне проблеме, али је ређи.[20] Компликације које настају услед ослабљених међуребарних мишића због недостатка стимулације од нерва. Дијафрагма је мање погођена него интеркостални мишићи. Једном ослабљени, мишићи никада у потпуности не опорављају исти функционални капацитет да помогну при дисању и кашљању, као и другим функцијама. Због тога је дисање теже и представља ризик од недовољно кисеоника/плитког дисања и недовољног чишћења секрета дисајних путева. Ови проблеми се чешће јављају при спавањуBiPAP, када су мишићи опуштенији. Мишићи гутања у фарингексу могу бити погођени, што доводи до аспирације у комбинацији са лошим механизмом кашљања повећава вероватноћу инфекције/пнеумоније.[51] Мобилизирање и чишћење секрета укључује ручну или механичку физиотерапију грудног коша са постуралном дренажом и ручним или механичким уређајем за помоћ при кашљању. Да би се помогло у дисању, често се користи неинвазивна вентилација (BiPAP), а трахеостомија се понекад може извести у тежим случајевима;[52] обе методе вентилације продужавају преживљавање у упоредивом степену, иако трахеостомија спречава развој говора.[53]
Исхрана
[уреди | уреди извор]Што је тежи тип СМА, већа је вероватноћа да ће особа имати здравствене проблеме у вези са исхраном. Здравствени проблеми могу укључивати потешкоће у храњењу, отварању вилице, жвакању и гутању. Појединци са таквим потешкоћама могу бити изложени повећаном ризику од прекомерне или потхрањености, неуспеха да напредују и тежње. Остала питања у вези са исхраном, посебно код особа које нису у покрету (теже врсте СМА), укључују храну која не пролази довољно брзо кроз стомак, гастрични рефлукс, констипацију, повраћање и надимање.[54] Може бити неопходно код СМА типа 1 и људи са тежим типом 2 да имају сонду за храњење или гастростому.[55][56] Поред тога, метаболичке абнормалности које су резултат СМА ометају β-оксидацију масних киселина у мишићима и могу довести до органске ацидемије и последичног оштећења мишића, посебно када се пости.[57] Предлаже се да људи са СМА, посебно они са тежим облицима болести, смање унос масти и избегавају продужено гладовање (тј. једу чешће од здравих људи)[58]
Прогноза
[уреди | уреди извор]У недостатку фармаколошког третмана, људи са СМА имају тенденцију да се погоршавају током времена. Недавно је повећано преживљавање код пацијената са тешким СМА са агресивном и проактивном респираторном и нутритивном подршком.[59]
Ако се не лечи, већина деце са дијагнозом СМА типа 0 и 1 не достигне 4 године, а поновљени респираторни проблеми су примарни узрок смрти.[60] Уз одговарајућу негу, блажи случајеви СМА типа 1 (који чине око 10% свих случајева СМА1) живе у одраслом добу.[61] Дуготрајно преживљавање код СМА типа 2 није довољно доказано; међутим, од 2007. године чини се да је напредак у респираторној подршци смањио смртност.[62]
Спинална мишићна атрофија у Србији
[уреди | уреди извор]Према подацима удружења оболелих, у Србији тренутно има 107 особа са дијагнозом спиналне мишићне атрофије. Лек Спинраза у Србији постоји већ две године и ту терапију прима 35 оболелих. Спинраза је прва терапија одобрена пре две године у Србији, након чега су одобрене још две, које су, према речима представника Удружења побољшале квалитет живота оболелима од ове болести.[63]
Референце
[уреди | уреди извор]- ^ а б в „Spinal Muscular Atrophy”. NORD (National Organization for Rare Disorders). Приступљено 27. 5. 2019.
- ^ а б в „Spinal muscular atrophy”. Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Приступљено 27. 5. 2019.
- ^ „ŠTA JE SMA? - Udruženje obolelih od spinalne mišićne atrofije”. Udruženje SMA Srbija (на језику: српски). Приступљено 2022-02-25.
- ^ а б „Spinal muscular atrophy”. nhs.uk (на језику: енглески). 2017-10-23. Приступљено 2020-10-24.
- ^ „Spinal muscular atrophy: MedlinePlus Genetics”. medlineplus.gov (на језику: енглески). Приступљено 2020-10-24.
- ^ „Spinal Muscular Atrophy (SMA) | Boston Children's Hospital”. www.childrenshospital.org. Приступљено 2020-10-25.
- ^ а б „FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality”. FDA (на језику: енглески). 24. 5. 2019. Приступљено 27. 5. 2019.
- ^ „Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke”. NINDS. Приступљено 27. 5. 2019.
- ^ а б в „Spinal muscular atrophy”. Genetics Home Reference (на језику: енглески). Приступљено 27. 5. 2019.
- ^ „Spinal Muscular Atrophy – Conditions | Children's National”. childrensnational.org. Приступљено 2020-10-25.
- ^ а б в Prior, Thomas W.; Leach, Meganne E.; Finanger, Erika (1993), Adam, Margaret P.; Ardinger, Holly H.; Pagon, Roberta A.; Wallace, Stephanie E., ур., „Spinal Muscular Atrophy”, GeneReviews®, Seattle (WA): University of Washington, Seattle, PMID 20301526, Приступљено 2020-10-25
- ^ Verhaart, Ingrid E. C.; Robertson, Agata; Leary, Rebecca; McMacken, Grace; König, Kirsten; Kirschner, Janbernd; Jones, Cynthia C.; Cook, Suzanne F.; Lochmüller, Hanns (јул 2017). „A multi-source approach to determine SMA incidence and research ready population”. Journal of Neurology (на језику: енглески). 264 (7): 1465—1473. ISSN 0340-5354. PMC 5502065
 . PMID 28634652. doi:10.1007/s00415-017-8549-1.
. PMID 28634652. doi:10.1007/s00415-017-8549-1.
- ^ „Spinal Muscular Atrophy”. NORD (National Organization for Rare Disorders). Приступљено 27. 5. 2019.
- ^ Dubowitz, Victor (2009). „Ramblings in the history of spinal muscular atrophy”. Neuromuscular Disorders (на језику: енглески). 19 (1): 69—73. PMID 18951794. S2CID 37576912. doi:10.1016/j.nmd.2008.10.004.
- ^ Charlotte J. Sumner, Sergey Paushkin, Chien-Ping Ko (2017). Spinal muscular atrophy : disease mechanisms and therapy. London. ISBN 978-0-12-803686-0. OCLC 961272280.
- ^ Brzustowicz LM, Lehner T, Castilla LH, Penchaszadeh GK, Wilhelmsen KC, Daniels R, Davies KE, Leppert M, Ziter F, Wood D (април 1990). „Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2–13.3”. Nature. 344 (6266): 540—1. Bibcode:1990Natur.344..540B. PMID 2320125. S2CID 4259327. doi:10.1038/344540a0.
- ^ „Spinal muscular atrophy”. Genetics Home Reference. Приступљено 2019-05-15.
- ^ Lefebvre S, Bürglen L, Reboullet S, Clermont O, Burlet P, Viollet L, Benichou B, Cruaud C, Millasseau P, Zeviani M (јануар 1995). „Identification and characterization of a spinal muscular atrophy-determining gene”. Cell. 80 (1): 155—65. PMID 7813012. S2CID 14291056. doi:10.1016/0092-8674(95)90460-3
 .
.
- ^ Passini MA, Bu J, Richards AM, Kinnecom C, Sardi SP, Stanek LM, Hua Y, Rigo F, Matson J, Hung G, Kaye EM, Shihabuddin LS, Krainer AR, Bennett CF, Cheng SH (март 2011). „Antisense oligonucleotides delivered to the mouse CNS ameliorate symptoms of severe spinal muscular atrophy”. Science Translational Medicine. 3 (72): 72ra18. PMC 3140425
 . PMID 21368223. doi:10.1126/scitranslmed.3001777.
. PMID 21368223. doi:10.1126/scitranslmed.3001777.
- ^ а б Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (август 2007). „Consensus statement for standard of care in spinal muscular atrophy”. Journal of Child Neurology. 22 (8): 1027—49. PMID 17761659. S2CID 6478040. doi:10.1177/0883073807305788.
- ^ Jedrzejowska M, Milewski M, Zimowski J, Borkowska J, Kostera-Pruszczyk A, Sielska D, Jurek M, Hausmanowa-Petrusewicz I (2009). „Phenotype modifiers of spinal muscular atrophy: the number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease”. Acta Biochimica Polonica. 56 (1): 103—8. PMID 19287802. doi:10.18388/abp.2009_2521
 .
.
- ^ Su YN, Hung CC, Lin SY, Chen FY, Chern JP, Tsai C, Chang TS, Yang CC, Li H, Ho HN, Lee CN (фебруар 2011). Schrijver I, ур. „Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005–2009: a prospective population-based cohort study”. PLOS ONE. 6 (2): e17067. Bibcode:2011PLoSO...617067S. PMC 3045421
 . PMID 21364876. doi:10.1371/journal.pone.0017067
. PMID 21364876. doi:10.1371/journal.pone.0017067  .
.
- ^ Sugarman EA, Nagan N, Zhu H, Akmaev VR, Zhou Z, Rohlfs EM, Flynn K, Hendrickson BC, Scholl T, Sirko-Osadsa DA, Allitto BA (јануар 2012). „Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens”. European Journal of Human Genetics. 20 (1): 27—32. PMC 3234503
 . PMID 21811307. doi:10.1038/ejhg.2011.134.
. PMID 21811307. doi:10.1038/ejhg.2011.134.
- ^ Oskoui M, Darras BT, DeVivo DC (2017). „Chapter 1”. Ур.: Sumner CJ, Paushkin S, Ko CP. Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. ISBN 978-0-12-803685-3.
- ^ Serra-Juhe C, Tizzano EF (децембар 2019). „Perspectives in genetic counseling for spinal muscular atrophy in the new therapeutic era: early pre-symptomatic intervention and test in minors”. European Journal of Human Genetics. 27 (12): 1774—1782. PMC 6871529
 . PMID 31053787. doi:10.1038/s41431-019-0415-4.
. PMID 31053787. doi:10.1038/s41431-019-0415-4.
- ^ Glascock J, Sampson J, Haidet-Phillips A, Connolly A, Darras B, Day J, et al. (2018-05-29). „Treatment Algorithm for Infants Diagnosed with Spinal Muscular Atrophy through Newborn Screening”. Journal of Neuromuscular Diseases. 5 (2): 145—158. PMC 6004919
 . PMID 29614695. doi:10.3233/JND-180304.
. PMID 29614695. doi:10.3233/JND-180304.
- ^ а б McCall, Sarah. „Newborn Screening for Spinal Muscular Atrophy”. Cure SMA (на језику: енглески). Приступљено 2020-05-04.
- ^ Stephenson, Kristin (2018-07-05). „SMA Added to National List of Disorders to Screen for at Birth”. Muscular Dystrophy Association (на језику: енглески). Приступљено 2020-05-04.
- ^ Chien YH, Chiang SC, Weng WC, Lee NC, Lin CJ, Hsieh WS, et al. (новембар 2017). „Presymptomatic Diagnosis of Spinal Muscular Atrophy Through Newborn Screening”. The Journal of Pediatrics. 190: 124—129.e1. PMID 28711173. S2CID 20621772. doi:10.1016/j.jpeds.2017.06.042.
- ^ Kariyawasam DS, Russell JS, Wiley V, Alexander IE, Farrar MA (март 2020). „The implementation of newborn screening for spinal muscular atrophy: the Australian experience”. Genetics in Medicine. 22 (3): 557—565. PMID 31607747. S2CID 204459317. doi:10.1038/s41436-019-0673-0
 .
.
- ^ Boemer F, Caberg JH, Dideberg V, Dardenne D, Bours V, Hiligsmann M, et al. (мај 2019). „Newborn screening for SMA in Southern Belgium”. Neuromuscular Disorders. 29 (5): 343—349. PMID 31030938. S2CID 72332212. doi:10.1016/j.nmd.2019.02.003.
- ^ Vill K, Kölbel H, Schwartz O, Blaschek A, Olgemöller B, Harms E, et al. (2019-10-31). „One Year of Newborn Screening for SMA – Results of a German Pilot Project”. Journal of Neuromuscular Diseases. 6 (4): 503—515. PMC 6918901
 . PMID 31594245. doi:10.3233/JND-190428.
. PMID 31594245. doi:10.3233/JND-190428.
- ^ Ministerie van Volksgezondheid, Welzijn en Sport (2019-07-23). „Neonatal screening for spinal muscular atrophy – Advisory report – The Health Council of the Netherlands”. www.healthcouncil.nl (на језику: енглески). Приступљено 2020-05-04.
- ^ Lin Y, Lin CH, Yin X, Zhu L, Yang J, Shen Y, et al. (2019). „Newborn Screening for Spinal Muscular Atrophy in China Using DNA Mass Spectrometry”. Frontiers in Genetics (на језику: енглески). 10: 1255. PMC 6928056
 . PMID 31921298. doi:10.3389/fgene.2019.01255
. PMID 31921298. doi:10.3389/fgene.2019.01255  .
.
- ^ Shinohara M, Niba ET, Wijaya YO, Takayama I, Mitsuishi C, Kumasaka S, Kondo Y, Takatera A, Hokuto I, Morioka I, Ogiwara K (децембар 2019). „A Novel System for Spinal Muscular Atrophy Screening in Newborns: Japanese Pilot Study”. International Journal of Neonatal Screening (на језику: енглески). 5 (4): 41. doi:10.3390/ijns5040041
 .
.
- ^ „Carrier Screening in the Age of Genomic Medicine – ACOG”. www.acog.org. Архивирано из оригинала 25. 02. 2017. г. Приступљено 24. 2. 2017.
- ^ Nilay, M, Moirangthem, A, Saxena, D, Mandal, K, Phadke, SR (октобар 2020). „Carrier frequency of SMN1 related spinal muscular atrophy in north Indian population: The need for population based screening program.”. American Journal of Medical Genetics Part A. 185 (1): 274—277. S2CID 222353383. doi:10.1002/ajmg.a.61918.
- ^ Ar Rochmah M, Awano H, Awaya T, Harahap NI, Morisada N, Bouike Y, Saito T, Kubo Y, Saito K, Lai PS, Morioka I, Iijima K, Nishio H, Shinohara M (новембар 2017). „Spinal muscular atrophy carriers with two SMN1 copies”. Brain & Development. 39 (10): 851—860. PMID 28676237. S2CID 26504674. doi:10.1016/j.braindev.2017.06.002.
- ^ Prior TW (новембар 2008). „Carrier screening for spinal muscular atrophy”. Genetics in Medicine. 10 (11): 840—2. PMC 3110347
 . PMID 18941424. doi:10.1097/GIM.0b013e318188d069.
. PMID 18941424. doi:10.1097/GIM.0b013e318188d069.
- ^ „Spinraza- nusinersen injection, solution”. DailyMed. 30. 6. 2020. Приступљено 8. 8. 2020.
- ^ а б „Spinraza- nusinersen injection, solution”. DailyMed. 30. 6. 2020. Приступљено 8. 8. 2020.
- ^ Finkel RS, Mercuri E, Darras BT, Connolly AM, Kuntz NL, Kirschner J, et al. (новембар 2017). „Nusinersen versus Sham Control in Infantile-Onset Spinal Muscular Atrophy”. New England Journal of Medicine. 377 (18): 1723—32. PMID 29091570. S2CID 4771819. doi:10.1056/NEJMoa1702752.
- ^ „Spinraza (nusinersen) Injection”. U.S. Food and Drug Administration (FDA). 18. 1. 2017. Приступљено 8. 8. 2020.
- ^ „Spinraza EPAR”. European Medicines Agency (EMA). Приступљено 8. 8. 2020.
- ^ „Zolgensma 2 x 1013 vector genomes/mL solution for infusion”. www.medicines.org.uk. Приступљено 8. 8. 2020.
- ^ „Zolgensma- onasemnogene abeparvovec-xioi kit”. DailyMed. 24. 5. 2019. Приступљено 8. 8. 2020.
- ^ „Zolgensma EPAR”. European Medicines Agency (EMA). 24. 3. 2020. Приступљено 8. 8. 2020.
- ^ „FDA Approves Oral Treatment for Spinal Muscular Atrophy”. U.S. Food and Drug Administration (FDA) (Саопштење). 7. 8. 2020. Приступљено 7. 8. 2020.
- ^ Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S, et al. (мај 2016). „Pharmacokinetics, pharmacodynamics, and efficacy of a small-molecule SMN2 splicing modifier in mouse models of spinal muscular atrophy”. Human Molecular Genetics. 25 (10): 1885—1899. PMC 5062580
 . PMID 26931466. doi:10.1093/hmg/ddw062.
. PMID 26931466. doi:10.1093/hmg/ddw062.
- ^ „FDA Approves Oral Treatment for Spinal Muscular Atrophy”. U.S. Food and Drug Administration (FDA) (Саопштење). 7. 8. 2020. Приступљено 7. 8. 2020.
- ^ Bodamer, Olaf (новембар 2017). „Spinal Muscular Atrophy”. uptodate.com. Приступљено 1. 12. 2017.
- ^ Bach JR, Niranjan V, Weaver B (април 2000). „Spinal muscular atrophy type 1: A noninvasive respiratory management approach”. Chest. 117 (4): 1100—5. PMID 10767247. doi:10.1378/chest.117.4.1100.
- ^ Bach JR, Saltstein K, Sinquee D, Weaver B, Komaroff E (мај 2007). „Long-term survival in Werdnig-Hoffmann disease”. American Journal of Physical Medicine & Rehabilitation. 86 (5): 339—45 quiz 346—8, 379. PMID 17449977. S2CID 9942245. doi:10.1097/PHM.0b013e31804a8505.
- ^ Messina S, Pane M, De Rose P, Vasta I, Sorleti D, Aloysius A, Sciarra F, Mangiola F, Kinali M, Bertini E, Mercuri E (мај 2008). „Feeding problems and malnutrition in spinal muscular atrophy type II”. Neuromuscular Disorders. 18 (5): 389—93. PMID 18420410. S2CID 23302291. doi:10.1016/j.nmd.2008.02.008.
- ^ Tilton AH, Miller MD, Khoshoo V (јун 1998). „Nutrition and swallowing in pediatric neuromuscular patients”. Seminars in Pediatric Neurology. 5 (2): 106—15. PMID 9661244. doi:10.1016/S1071-9091(98)80026-0.
- ^ Messina S, Pane M, De Rose P, Vasta I, Sorleti D, Aloysius A, Sciarra F, Mangiola F, Kinali M, Bertini E, Mercuri E (мај 2008). „Feeding problems and malnutrition in spinal muscular atrophy type II”. Neuromuscular Disorders. 18 (5): 389—93. PMID 18420410. S2CID 23302291. doi:10.1016/j.nmd.2008.02.008.
- ^ Tein I, Sloane AE, Donner EJ, Lehotay DC, Millington DS, Kelley RI (јануар 1995). „Fatty acid oxidation abnormalities in childhood-onset spinal muscular atrophy: primary or secondary defect(s)?”. Pediatric Neurology. 12 (1): 21—30. PMID 7748356. doi:10.1016/0887-8994(94)00100-G.
- ^ Apkon, Susan (лето 2017). „SMA CARE SERIES – Musculoskeletal System” (PDF). www.curesma.org. Архивирано из оригинала (PDF) 19. 02. 2018. г. Приступљено 25. 02. 2022.
- ^ Darras, Basil; Finkel, Richard (2017). Spinal Muscular Atrophy. United Kingdom, United States: Elsevier. стр. 417. ISBN 978-0-12-803685-3.
- ^ Yuan N, Wang CH, Trela A, Albanese CT (јун 2007). „Laparoscopic Nissen fundoplication during gastrostomy tube placement and noninvasive ventilation may improve survival in type I and severe type II spinal muscular atrophy”. Journal of Child Neurology. 22 (6): 727—31. PMID 17641258. S2CID 38799022. doi:10.1177/0883073807304009.
- ^ Bach JR (мај 2007). „Medical considerations of long-term survival of Werdnig-Hoffmann disease”. American Journal of Physical Medicine & Rehabilitation. 86 (5): 349—55. PMID 17449979. S2CID 39989993. doi:10.1097/PHM.0b013e31804b1d66.
- ^ Oskoui M, Levy G, Garland CJ, Gray JM, O'Hagen J, De Vivo DC, Kaufmann P (новембар 2007). „The changing natural history of spinal muscular atrophy type 1”. Neurology. 69 (20): 1931—6. PMID 17998484. S2CID 7528894. doi:10.1212/01.wnl.0000290830.40544.b9.
- ^ „Spinalna mišićna atrofija”. N1 (на језику: српски). 2020-08-16. Приступљено 2022-02-25.
Спољашње везе
[уреди | уреди извор]| Класификација | |
|---|---|
| Спољашњи ресурси |
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
