Srebro azid

| |
| Identifikacija | |
|---|---|
3D model (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.034.173 |
| |
| Svojstva | |
| AgN3 | |
| Molarna masa | 149,888 |
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje materijala (na 25 °C [77 °F], 100 kPa). | |
| Reference infokutije | |
Srebro azid je hemijsko jedinjenje sa formulom AgN
3, koje ima molekulsku masu od 149,888 Da. To je srebrna (I) so hidrazoinske kiseline. Formira bezbojne kristale. Kao i većina azida, primarni je eksploziv.
Proizvodnja
[уреди | уреди извор]Srebrni azid se može dobiti reakcijom natrijum azida sa Srebro nitratom:[3]
Osobine
[уреди | уреди извор]| Osobina | Vrednost |
|---|---|
| Broj akceptora vodonika | 2 |
| Broj donora vodonika | 0 |
| Broj rotacionih veza | 0 |
| Particioni koeficijent[4] (ALogP) | 0,3 |
| Rastvorljivost[5] (logS, log(mol/L)) | 2,2 |
| Polarna površina[6] (PSA, Å2) | 94,1 |
Karakteristike
[уреди | уреди извор]Srebrni azid je u obliku bezbojnih kristalnih igala. Izuzetno je eksplozivan i osetljiv na udar i zagrevanje. Kada je izložen svetlosti, boja postepeno tamni. Temperatura omekšavanja je 250 °C (482 °F; 523 K), potpuno topljenje se dešava samo na 300 °C (572 °F; 573 K) da bi se formirala srebrnasta tečnost (sa razlaganjem). Brzo zagrevanje na 300 °C (572 °F; 573 K) izaziva eksploziju. Njegova kristalna struktura je rombična pseudotetragonalna sa prostornom grupom Ibam (a = 5,6, b = 5,9, c = 6,0 A). Entalpija formiranja je +279,5 kJ/mol.[3]
Srebrni azid je jedan od najefikasnijih primarnih eksploziva; Punjenje od 5 mg slabo obloženog srebrnog azida je dovoljno da detonira nitropentu labavo napunjenu u detonatorsku kapislu kada se zapali (uporedivo efektivno punjenje je 15 mg za olovo azid, 300 mg za živu i 550 mg za olovni trinitroresorcinat u istoj eksperimentalnoj proceduri).[7][8] Srebrni azid se odlikuje činjenicom da detonira odmah nakon paljenja (tj. bez prethodne deflagracije); Stoga se u ruskoj i češkoj literaturi svrstava u takozvanu grupu azida olova inicijalnih eksploziva (zajedno sa azidom olova i srebrnim fulminatom; primarni eksplozivi koji nakon paljenja prelaze od deflagracije do detonacije, kao što su oksivodonik živa, olovni stifnat ili neki organski peroksidi se svrstavaju u takozvanu grupu oksivodonik žive).[9] Srebrni azid karakteriše veoma mali kritični prečnik punjenja, koji i dalje može da podrži stabilnu detonaciju, kao i veća otpornost na ugljen-dioksid u vlažnoj sredini u poređenju sa olovnim azidom; Međutim, kao i sve soli srebra, osetljiva je na svetlost. Brzina detonacije punjenja srebrnog azida je 1000–5000 m/s, u zavisnosti od gustine i geometrije punjenja. Srebrni azid, kao i drugi primarni eksplozivi grupe olovnih azida, ne može biti „mrtvo presovan” (tj. komprimovan pritiskom na takav način da ne dođe do detonacije nakon paljenja).[10] Osetljivost srebrnog azida na udar je niža od žive i približno je uporediva sa onom azida olova; Osetljivost na trenje zavisi od metode proizvodnje i veličine kristala proizvoda i otprilike je uporediva sa onim azida olova; osetljivost na elektrostatičko pražnjenje je veća od one kod olovnog azida; Slično, osetljivost na plamen ili „spremnost da se zapali“ srebrnog azida veća je od one kod azida olova, otprilike uporediva sa živinom.[11]
Srebro azid (AgN3) je neorgansko jedinjenje koje se sastoji od srebra i azidnog anjona (N3-). Poznato je po svojoj visokoj eksplozivnosti i koristi se u nekim vrstama detonatora i pirotehničkih uređaja. Jedinjenje je osetljivo na udar, trenje i promene temperature, što ga čini veoma opasnim za rukovanje.
Sinteza: Srebro azid se može sintetisati reakcijom srebrovih soli, kao što je srebro nitrat (AgNO3), sa natrijum azidom (NaN3) u vodenom rastvoru. Reakcija je sledeća:
Pri tome se srebro azid taloži kao beli precipitat. S obzirom na njegovu eksplozivnost, proces sinteze zahteva poseban oprez i kontrolisane uslove.
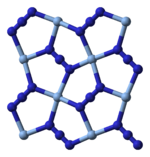
Struktura: Srebro azid kristališe u tricliničnoj kristalnoj strukturi. Azidni anjon je linearni, sastoji se od tri azotna atoma povezana dvostrukim i trostrukim vezama koje se smenjuju (N=N+=N-). Srebro azid formira polimere u čvrstom stanju, gde su srebrovi atomi koordinisani sa azidnim grupama.
Svojstva: Srebro azid je vrlo nestabilno i eksplozivno jedinjenje. Može eksplodirati pod uticajem udara, trenja, zagrevanja ili čak spontano. Eksplozija srebrovog azida proizvodi srebro i azotne gasove, što je karakteristično za mnoge azidne eksplozive. Zbog svoje nestabilnosti, srebro azid se retko koristi u komercijalne svrhe, osim u vrlo malim količinama i pod strogim sigurnosnim merama.
Upotreba: Srebro azid se koristi kao inicijator ili primarni eksploziv u nekim vrstama detonatora. Zbog svoje osetljivosti na udar, može se koristiti za iniciranje sekundarnih eksploziva koji su manje osetljivi, ali imaju veću eksplozivnu moć. Takođe, koristi se u laboratorijskim istraživanjima za proučavanje eksplozivnih materijala i detonacijskih mehanizama.
Bezbednost: Zbog svoje visoke eksplozivnosti, rukovanje srebrovim azidom zahteva posebne mere opreza. Laboratorijske količine treba da budu veoma male, a eksperimentisanje sa ovim jedinjenjem treba da se obavlja u zaštitnim komorama ili na drugim bezbednim mestima. Potrebno je koristiti odgovarajuću zaštitnu opremu i izbegavati bilo kakve radnje koje bi mogle dovesti do udarca, trenja ili naglog zagrevanja materijala.
Odlaganje: Srebro azid je neophodno odlagati na odgovarajući način, obično putem neutralizacije ili kontrolisane detonacije pod nadzorom stručnjaka za eksplozive. Ne sme se odlagati u obične otpadne kanale zbog rizika od nekontrolisane detonacije.
Zaključak: Srebro azid je interesantno, ali izuzetno opasno jedinjenje koje se koristi u specijalizovanim aplikacijama. Njegovo rukovanje zahteva specijalizovano znanje i oprez, a njegova primena je ograničena zbog inherentnih rizika.
Struktura i hemija
[уреди | уреди извор]Srebrni azid se može pripremiti tretiranjem vodenog rastvora srebrnog nitrata sa natrijum azidom.[12] Srebrni azid precipitira kao bela čvrsta supstanca, ostavljajući natrijum nitrat u rastvoru.
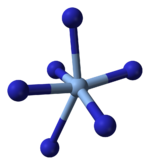
Rendgenska kristalografija pokazuje da je AgN
3 koordinacioni polimer sa kvadratnim ravnim Ag+
koordinisanim sa četiri azidna liganda. U skladu sa tim, svaki kraj svakog azidnog liganda je povezan sa parom Ag+
centara. Struktura se sastoji od dvodimenzionalnih AgN
3 slojeva naslaganih jedan na drugi, sa slabijim Ag-N vezama između slojeva. Koordinacija Ag+
može se alternativno opisati kao veoma izobličena 4 + 2 oktaedarska, pri čemu su dva udaljenija atoma azota deo slojeva iznad i ispod.[13]
U svojoj najkarakterističnijoj reakciji, čvrsta supstanca se eksplozivno raspada, oslobađajući gas azota:
- 2 AgN
3(s) → 3 N
2(g) + 2 Ag(s)
Prvi korak u ovoj dekompoziciji je proizvodnja slobodnih elektrona i azidnih radikala; tako se brzina reakcije povećava dodavanjem poluprovodnih oksida.[14] Čisti srebrni azid eksplodira na 340 °C (644 °F; 613 K), ali prisustvo nečistoća to snižava na 270 °C (518 °F; 543 K).[15] Ova reakcija ima nižu energiju aktivacije i početno kašnjenje od odgovarajućeg razlaganja azida olova.[16]
Upotreba
[уреди | уреди извор]Glavna prepreka širokoj upotrebi srebrnog azida kao primarnog eksploziva je njegova visoka cena. Prijavljena je njegova upotreba u malim, snažnim detonatorima.[17] Dalje, kao primarni eksploziv je ranije korišćena mešavina 97% eksplozivne žive i 3% srebrnog azida, koja je imala prednosti oba primarna eksploziva (niža cena eksplozivne žive i njena kompatibilnost sa sa bakarnim omotačima lima, kao i jači početni efekat i mogućnost visokih gustina punjenja bez gubitka sposobnosti detonacije), dodatkom srebrnog azida) koji se trguje pod trgovačkim nazivom „Astril“.[18] Međutim, ova primena je samo od istorijskog interesa zbog opšteg izbegavanja jedinjenja žive u tehnologiji miniranja.
Srebro azid, poznat po svojoj visokoj reaktivnosti i sposobnosti da se detonira, našao je svoju primenu u različitim industrijama, ali je posebno značajan u proizvodnji detonatora i inicijatora eksploziva. Njegova sposobnost da generiše brzu i snažnu eksploziju čini ga idealnim za upotrebu u situacijama gde je potrebno precizno iniciranje većih eksploziva.
U vojnim primenama, srebro azid se često koristi u detonatorima koji aktiviraju različite vrste municije, od artiljerijskih granata do bombi i mina. Njegova brza i pouzdana detonacija omogućava vojnicima precizno kontrolisanje vremena i mesta eksplozije, što je od suštinskog značaja za efikasnost vojnih operacija. Osim toga, zbog svoje stabilnosti pri normalnim uslovima, srebro azid je pogodan za skladištenje i rukovanje u vojnim arsenalima.
U civilnoj upotrebi, srebro azid se primenjuje u pirotehničkoj industriji, gde se koristi za iniciranje vatrometa i drugih pirotehničkih efekata. Njegova sposobnost da proizvede brzu eksploziju omogućava stvaranje spektakularnih vizuelnih i zvučnih efekata koji su ključni za pirotehničke prikaze.
U oblasti rudarstva i građevinarstva, srebro azid se koristi za iniciranje eksploziva koji se upotrebljavaju za razbijanje stena i drugih tvrdih materijala. Preciznost koju pruža srebro azid omogućava kontrolisano rušenje i smanjuje verovatnoću neželjenih posledica, kao što su nekontrolisane eksplozije i oštećenje okolnih struktura.
Iako su njegove primene široko rasprostranjene, proizvodnja i upotreba srebrovog azida su strogo regulisane zbog njegovih opasnih svojstava. Industrije koje ga koriste moraju se pridržavati strogih bezbednosnih protokola kako bi osigurale sigurnost radnika i okoline. Obuka za rukovanje srebrovim azidom je obavezna, a osoblje koje ga koristi mora biti svesno potencijalnih rizika i sposobno da reaguje u slučaju nesreće.
Zbog svoje opasnosti, primena srebrovog azida se postepeno smanjuje, a u nekim slučajevima se zamenjuje manje opasnim alternativama. Razvoj novih tehnologija i materijala može dalje smanjiti potrebu za srebrovim azidom, ali njegova upotreba i dalje ostaje relevantna u određenim specijalizovanim aplikacijama gde su njegove jedinstvene karakteristike i dalje nezamenjive.
Bezbednost
[уреди | уреди извор]AgN
3, kao i većina azida teških metala, je opasan primarni eksploziv. Razlaganje može biti izazvano izlaganjem ultraljubičastom svetlu ili udarom.[12] Cerijev amonijum nitrat [NH
4]
2[Ce(NO
3)
6] se koristi kao oksidaciono sredstvo za uništavanje AgN
3 u izlivu.[15]
Opšta slika bezbednosti u vezi sa srebrovim azidom: Srebro azid (AgN3) je hemijski spoj poznat po svojoj visokoj eksplozivnosti i osetljivosti na udar, trenje, toplotu i elektrostatski naboj. Zbog ovih svojstava, rukovanje srebrovim azidom zahteva izuzetan oprez i strogo pridržavanje sigurnosnih protokola. U laboratorijskim uslovima i industrijskoj primeni, bezbednost se osigurava kroz niz mera koje uključuju kontrolisano okruženje, specijalizovanu opremu i obučeno osoblje.
Aspekti bezbednosti pri eksperimentisanju: Pri eksperimentisanju sa srebrovim azidom, važno je raditi u dobro ventiliranoj prostoriji ili pod fume hood-om kako bi se izbeglo udisanje štetnih gasova. Laboratorijski pribor treba da bude čist i suv, bez tragova drugih hemikalija koje bi mogle izazvati neželjene reakcije. Količine srebrovog azida koje se koriste u eksperimentima trebaju biti minimalne i rukovane s velikom pažnjom. Eksperimenti se obavljaju iza zaštitnih barijera ili koristeći daljinske manipulatore.
Rukovanje i skladištenje: Rukovanje srebrovim azidom zahteva upotrebu odgovarajuće zaštitne opreme, uključujući zaštitne naočare, rukavice otporne na hemikalije, laboratorijski mantil i, u nekim slučajevima, respirator. Srebro azid se čuva u stabilnim uslovima, daleko od izvora toplote, iskri i direktnog sunčevog svetla, kao i od materijala koji mogu izazvati trenje ili udar. Skladištenje se vrši u posebnim kontejnerima koji su jasno označeni i izolovani od drugih materijala.
Transport: Transport srebrovog azida je takođe kritičan aspekt bezbednosti. Mora se osigurati da se transportuje u skladu sa propisima za opasne materijale, uključujući odgovarajuće označavanje, pakovanje i dokumentaciju. Transport se obično vrši u malim količinama, unutar otpornih i hermetički zatvorenih kontejnera, a vozači i osoblje zaduženo za transport moraju biti obučeni za rukovanje opasnim materijalima.
Odlaganje: Odlaganje srebrovog azida mora se obaviti na način koji ne predstavlja rizik za ljude ili okolinu. To obično zahteva neutralizaciju hemikalije pod kontrolisanim uslovima, često uz pomoć kvalifikovanih otpadnih menadžment servisa. Otpadni materijal se tretira sa velikim oprezom, a svi ostaci se moraju zbrinuti u skladu sa lokalnim, nacionalnim i međunarodnim propisima.
Obuka i svest o rizicima: Ključni deo bezbednosne prakse je obuka osoblja koje rukuje sa srebrovim azidom. Osoblje mora biti potpuno upoznato sa rizicima i procedurama u slučaju nesreće, uključujući prvu pomoć i evakuaciju. Redovne obuke i simulacije nesreća mogu pomoći u očuvanju visokog nivoa svesti o bezbednosti.
Zaključak: Srebro azid je materijal koji zahteva visok nivo opreza i strogu primenu bezbednosnih mera. Ove mere obuhvataju sve aspekte rukovanja, od laboratorijskog eksperimentisanja do skladištenja, transporta i odlaganja. Pravilna obuka i svest o opasnostima koje ovaj materijal nosi su ključni za sprečavanje nesreća i zaštitu kako ljudi, tako i okoline.
Uticaj srebrovog azida na okolinu
[уреди | уреди извор]Srebro azid (AgN3) je hemijsko jedinjenje koje, iako korisno u određenim aplikacijama, predstavlja potencijalnu opasnost za okolinu i zdravlje ljudi.
Toksičnost srebrovog azida: Srebro azid je toksičan za ljudske organe i tkiva. Kao i drugi teški metali, srebro može biti toksično za vodene organizme i može se akumulirati u prehrambenim lancima, što može dovesti do dugoročnih ekoloških problema. Toksični efekti srebrovog azida mogu uključivati oštećenje unutrašnjih organa, nervnog sistema i reproduktivnih funkcija kod izloženih organizama.
Eksplozivna priroda i rizici: Srebro azid je visoko eksplozivno jedinjenje koje može uzrokovati ozbiljne eksplozije čak i pri malim količinama. Ne samo da eksplozije predstavljaju neposrednu opasnost za ljude i infrastrukturu, već mogu imati i negativan uticaj na okolinu, uključujući požare, oslobađanje toksičnih gasova i uništavanje staništa.
Oslobađanje azotnih oksida: Prilikom eksplozije srebrovog azida oslobađaju se azotni gasovi (N2), koji nisu direktno toksični za okolinu u obliku u kojem se oslobađaju. Međutim, azotni oksidi koji mogu nastati u reakcijama sa kiseonikom u atmosferi su zagađivači koji doprinose stvaranju smoga, kiseline kiše i ozonskog sloja, što može imati štetne efekte na zdravlje ljudi, biljke i životinje.
Kontaminacija vode i tla: Ako srebro azid dospe u zemljište ili vodene puteve, može doći do kontaminacije koja može uticati na biljni i životinjski svet. Srebro može biti toksično za mikroorganizme u tlu, što može narušiti ekosistemske procese kao što su razgradnja materije i ciklusi hranljivih materija.
Uticaj na biljni svet: Srebro i njegovi spojevi mogu biti fitotoksični, što znači da mogu inhibirati rast i razvoj biljaka. To može dovesti do smanjenja biodiverziteta i narušavanja lokalnih ekosistema.
Zdravstveni rizici za ljude: Radnici koji rukuju sa srebrovim azidom mogu biti izloženi riziku od trovanja ukoliko dođe do inhalacije prašine ili gasova, ili ako jedinjenje dospe na kožu. Potrebno je koristiti odgovarajuću zaštitnu opremu i postupke kako bi se smanjio rizik od izlaganja.
Dugoročni ekološki rizici: Dugoročni uticaj srebrovog azida na okolinu zavisi od količine i učestalosti izlaganja. Akumulacija srebra u okolini može dovesti do postepenog povećanja koncentracija, što može imati toksične efekte na lokalne ekosisteme tokom vremena.
Zaključak: S obzirom na navedene rizike, važno je da se prilikom rukovanja srebrovim azidom primenjuju stroge sigurnosne mere, uključujući odgovarajuće metode skladištenja, rukovanja i odlaganja. Takođe je potrebno sprovesti redovne ekološke procene kako bi se osiguralo da ne dođe do štetnog uticaja na okolinu i zdravlje ljudi.
Vidi još
[уреди | уреди извор]Reference
[уреди | уреди извор]- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1002.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Robert Matyáš, Jiří Pachman (2013), Primary Explosives (на језику: немачки), Heidelberg / New York / Dordrecht / London: Springer, pp. 19 und 93, ISBN 978-3-642-28435-9
- ^ Tadeusz Urbański (1985), Chemistry and Technology of Explosives (на језику: немачки), 3 (4 изд.), Oxford / New York / Toronto / Sydney / Paris / Frankfurt: Pergamon Press, pp. 177 und 182, ISBN 0-08-010401-0
- ^ Robert Matyáš, Jiří Pachman (2013), Primary Explosives (на језику: немачки), Heidelberg / New York / Dordrecht / London: Springer, p. 2, ISBN 978-3-642-28435-9
- ^ Robert Matyáš, Jiří Pachman (2013), Primary Explosives (на језику: немачки), Heidelberg / New York / Dordrecht / London: Springer, pp. 92–93, ISBN 978-3-642-28435-9
- ^ Robert Matyáš, Jiří Pachman (2013), Primary Explosives (на језику: немачки), Heidelberg / New York / Dordrecht / London: Springer, pp. 91–92, ISBN 978-3-642-28435-9
- ^ а б Robert Matyas, Jiri Pachman (2013). Primary Explosives (1st изд.). Springer. стр. 93. ISBN 978-3-642-28435-9.[1]
- ^ Schmidt, C. L. Dinnebier, R.; Wedig, U.; Jansen, M. (2007). „Crystal Structure and Chemical Bonding of the High-Temperature Phase of AgN3”. Inorganic Chemistry. 46 (3): 907—916. PMID 17257034. doi:10.1021/ic061963n.
- ^ Andrew Knox Galwey; Michael E. Brown (1999). Thermal decomposition of ionic solids (vol.86 of Studies in physical and theoretical chemistry. Elsevier. стр. 335. ISBN 978-0-444-82437-0.
- ^ а б Margaret-Ann Armour (2003). Hazardous laboratory chemicals disposal guide, Environmental Chemistry and Toxicology (3rd изд.). CRC Press. стр. 452. ISBN 978-1-56670-567-7.
- ^ Jehuda Yinon; Shmuel Zitrin (1996). Modern Methods and Applications in Analysis of Explosives. John Wiley and Sons. стр. 15–16. ISBN 978-0-471-96562-6.
- ^ Tadeusz Urbański (1984), Chemistry and Technology of Explosives (на језику: немачки), 4, Oxford / New York / Toronto / Sydney / Paris / Frankfurt: Pergamon Press, pp. 485–486, ISBN 0-08-026206-6
- ^ Robert Matyáš, Jiří Pachman (2013), Primary Explosives (на језику: немачки), Heidelberg / New York / Dordrecht / London: Springer, p. 94, ISBN 978-3-642-28435-9
Literatura
[уреди | уреди извор]- Holleman A. F.; Wiberg E. (2001). Inorganic Chemistry (1st изд.). San Diego: Academic Press. ISBN 0-12-352651-5.
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
Spoljašnje veze
[уреди | уреди извор]