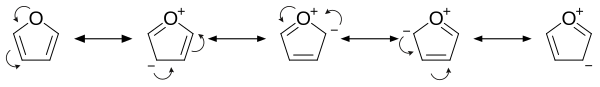Фуран
| |||

| |||
| Називи | |||
|---|---|---|---|
| IUPAC назив
Furan
| |||
| Други називи | |||
| Идентификација | |||
3Д модел (Jmol)
|
|||
| ChemSpider | |||
| ECHA InfoCard | 100.003.390 | ||
| КЕГГ[2] | |||
| |||
| Својства | |||
| C4H4O | |||
| Моларна маса | 68,07 g/mol | ||
| Агрегатно стање | безбојна, испарљива течност | ||
| Густина | 0,936 g/mL | ||
| Тачка топљења | -85.6 °C | ||
| Тачка кључања | 31.4 °C | ||
| Опасности | |||
| Тачка паљења | -35 °C | ||
| Сродна једињења | |||
Сродне хетероциклично једињење
|
Пирол Тиофен | ||
Сродна једињења
|
Тетрахидрофуран (ТХФ) 2,5-Диметилфуран Бензофуран Дибензофуран | ||
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |||
| Референце инфокутије | |||
Фуран је хетероциклично органско једињење, које се састоји од петочланог ароматичног прстена са четири угљеника и једним кисеоником. Класа једињења које садржи овај прстен се називају фуранима.[5][6]
Фуран је безбојна, запаљива, високо испарљива течност са тачком кључања близо собне температуре. Он је токсичан и карциноген. Фуран се користи као почетни материјал за синтезу других хемикалија.[7]
Производња[уреди | уреди извор]
Фуран се индустријски производи паладијум-катализованом декарбоксилацијом фурфурала, или бакром-катализованом оксидацијом 1,3-бутадиена.[7]
У лабораторији се фуран може добити из фурфурала оксидацијом до фуран-2-карбоксилне киселине, и накнадном декарбоксилацијом.[8]. Он се такође може припремити директно термалном декомпозицијом материјала који садржи пентозу, целулозну масу, посебно дрво бора
Хемијске особине[уреди | уреди извор]
Фуран је ароматичан јер је један од слободних парова електрона на атому кисеоника делокализован у прстену, чиме се формира 4n+2 ароматични систем (по Хукеловом правилу) слично бензену. Због ароматичности молекул је раван и нема дискретне двоструке везе. Други слободни електронски пар атома кисеоника је у равни прстена. sp2 хибридизација омогућава једном слободном пару кисеоника да се налази у p орбитали и да стога интерагује унутар pi-система.
Као последица ароматичности, фураново понашање се веома разликује од типичних хетероцикличних етара као што је тетрахидрофуран.
- Он је знатно реактивнији од бензена у реакцијама електрофилне супституције због електрон-донирајућих ефеката кисеониковог хетероатома. Преглед резонантних доприноса указује на повећану електронску густину прстена, што доводи до повећане електрофилне супституције.[9]
- Фуран служи као диен у Диелс-Алдеровим реакцијама са електрон-дефицитарним диенофилима као што је етил (Е)-3-нитроацрилат.[10] Реакциони продукт је мешавина изомера са преференцијом за ендо изомер:
- Хидрогенација фурана производи дихидрофуране и тетрахидрофуране
- У Achmatowicz реакцији, фурани се конвертују у дихидропиране.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ „Wебстер'с Онлине Дицтионарy”. Архивирано из оригинала 09. 06. 2011. г. Приступљено 06. 08. 2011.
- ^ Јоанне Wиxон; Доуглас Келл (2000). „Wебсите Ревиеw: Тхе Кyото Енцyцлопедиа оф Генес анд Геномес — КЕГГ”. Yеаст. 17 (1): 48—55. дои:10.1002/(СИЦИ)1097-0061(200004)17:1<48::АИД-YЕА2>3.0.ЦО;2-Х.
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart; Wothers, Peter (2001). Organic Chemistry (I изд.). Oxford University Press. ISBN 978-0-19-850346-0.
- ^ Katritzky A.R.; Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry (Second изд.). Academic Press. ISBN 0080429882.
- ^ а б H. E. Hoydonckx, W. M. Van Rhijn, W. Van Rhijn, D. E. De Vos, P. A. Jacobs (2005). „Furfural and Derivatives”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a12_119.pub2.
- ^ Wilson, W.C. (1941). „Furan”. Org. Synth.; Coll. Vol., 1, стр. 274
- ^ Bruice, Paula Y. (2007). Organic Chemistry (Fifth изд.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ^ Masesane I, Batsanov A, Howard J, Modal R, Steel P (2006). „The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid”. Beilstein Journal of Organic Chemistry. 2 (9): 9. PMC 1524792
 . PMID 16674802. doi:10.1186/1860-5397-2-9.
. PMID 16674802. doi:10.1186/1860-5397-2-9.
Литература[уреди | уреди извор]
- Bruice, Paula Y. (2007). Organic Chemistry (Fifth изд.). Upper Saddle River, NJ: Pearson Prentice Hall. ISBN 978-0-13-196316-0.