Сребро азид

| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.034.173 |
| |
| Својства | |
| AgN3 | |
| Моларна маса | 149,888 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
Сребро азид је хемијско једињење са формулом АгН
3, које има молекулску масу од 149,888 Da. То је сребрна (I) со хидразоинске киселине. Формира безбојне кристале. Као и већина азида, примарни је експлозив.
Производња[уреди | уреди извор]
Сребрни азид се може добити реакцијом натријум азида са Сребро нитратом:[3]
Особине[уреди | уреди извор]
| Особина | Вредност |
|---|---|
| Број акцептора водоника | 2 |
| Број донора водоника | 0 |
| Број ротационих веза | 0 |
| Партициони коефицијент[4] (ALogP) | 0,3 |
| Растворљивост[5] (logS, log(mol/L)) | 2,2 |
| Поларна површина[6] (PSA, Å2) | 94,1 |
Карактеристике[уреди | уреди извор]
Сребрни азид је у облику безбојних кристалних игала. Изузетно је експлозиван и осетљив на удар и загревање. Када је изложен светлости, боја постепено тамни. Температура омекшавања је 250 °Ц (482 °Ф; 523 К), потпуно топљење се дешава само на 300 °Ц (572 °Ф; 573 К) да би се формирала сребрнаста течност (са разлагањем). Брзо загревање на 300 °Ц (572 °Ф; 573 К) изазива експлозију. Његова кристална структура је ромбична псеудотетрагонална са просторном групом Ибам (а = 5,6, б = 5,9, ц = 6,0 А). Енталпија формирања је +279,5 кЈ/мол.[3]
Сребрни азид је један од најефикаснијих примарних експлозива; Пуњење од 5 мг слабо обложеног сребрног азида је довољно да детонира нитропенту лабаво напуњену у детонаторску капислу када се запали (упоредиво ефективно пуњење је 15 мг за олово азид, 300 мг за живу и 550 мг за оловни тринитроресорцинат у истој експерименталној процедури).[7][8] Сребрни азид се одликује чињеницом да детонира одмах након паљења (тј. без претходне дефлаграције); Стога се у руској и чешкој литератури сврстава у такозвану групу азида олова иницијалних експлозива (заједно са азидом олова и сребрним фулминатом; примарни експлозиви који након паљења прелазе од дефлаграције до детонације, као што су оксиводоник жива, оловни стифнат или неки органски пероксиди се сврставају у такозвану групу оксиводоник живе).[9] Сребрни азид карактерише веома мали критични пречник пуњења, који и даље може да подржи стабилну детонацију, као и већа отпорност на угљен-диоксид у влажној средини у поређењу са оловним азидом; Међутим, као и све соли сребра, осетљива је на светлост. Брзина детонације пуњења сребрног азида је 1000–5000 м/с, у зависности од густине и геометрије пуњења. Сребрни азид, као и други примарни експлозиви групе оловних азида, не може бити „мртво пресован” (тј. компримован притиском на такав начин да не дође до детонације након паљења).[10] Осетљивост сребрног азида на удар је нижа од живе и приближно је упоредива са оном азида олова; Осетљивост на трење зависи од методе производње и величине кристала производа и отприлике је упоредива са оним азида олова; осетљивост на електростатичко пражњење је већа од оне код оловног азида; Слично, осетљивост на пламен или „спремност да се запали“ сребрног азида већа је од оне код азида олова, отприлике упоредива са живином.[11]
Сребро азид (АгН3) је неорганско једињење које се састоји од сребра и азидног ањона (Н3-). Познато је по својој високој експлозивности и користи се у неким врстама детонатора и пиротехничких уређаја. Једињење је осетљиво на удар, трење и промене температуре, што га чини веома опасним за руковање.
Синтеза: Сребро азид се може синтетисати реакцијом сребрових соли, као што је сребро нитрат (АгНО3), са натријум азидом (НаН3) у воденом раствору. Реакција је следећа:
При томе се сребро азид таложи као бели преципитат. С обзиром на његову експлозивност, процес синтезе захтева посебан опрез и контролисане услове.
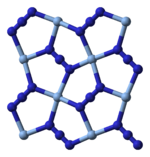
Структура: Сребро азид кристалише у трицлиничној кристалној структури. Азидни ањон је линеарни, састоји се од три азотна атома повезана двоструким и троструким везама које се смењују (Н=Н+=Н-). Сребро азид формира полимере у чврстом стању, где су среброви атоми координисани са азидним групама.
Својства: Сребро азид је врло нестабилно и експлозивно једињење. Може експлодирати под утицајем удара, трења, загревања или чак спонтано. Експлозија сребровог азида производи сребро и азотне гасове, што је карактеристично за многе азидне експлозиве. Због своје нестабилности, сребро азид се ретко користи у комерцијалне сврхе, осим у врло малим количинама и под строгим сигурносним мерама.
Употреба: Сребро азид се користи као иницијатор или примарни експлозив у неким врстама детонатора. Због своје осетљивости на удар, може се користити за иницирање секундарних експлозива који су мање осетљиви, али имају већу експлозивну моћ. Такође, користи се у лабораторијским истраживањима за проучавање експлозивних материјала и детонацијских механизама.
Безбедност: Због своје високе експлозивности, руковање сребровим азидом захтева посебне мере опреза. Лабораторијске количине треба да буду веома мале, а експериментисање са овим једињењем треба да се обавља у заштитним коморама или на другим безбедним местима. Потребно је користити одговарајућу заштитну опрему и избегавати било какве радње које би могле довести до ударца, трења или наглог загревања материјала.
Одлагање: Сребро азид је неопходно одлагати на одговарајући начин, обично путем неутрализације или контролисане детонације под надзором стручњака за експлозиве. Не сме се одлагати у обичне отпадне канале због ризика од неконтролисане детонације.
Закључак: Сребро азид је интересантно, али изузетно опасно једињење које се користи у специјализованим апликацијама. Његово руковање захтева специјализовано знање и опрез, а његова примена је ограничена због инхерентних ризика.
Структура и хемија[уреди | уреди извор]
Сребрни азид се може припремити третирањем воденог раствора сребрног нитрата са натријум азидом.[12] Сребрни азид преципитира као бела чврста супстанца, остављајући натријум нитрат у раствору.
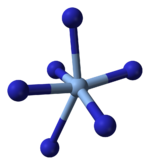
Рендгенска кристалографија показује да је АгН
3 координациони полимер са квадратним равним Аг+
координисаним са четири азидна лиганда. У складу са тим, сваки крај сваког азидног лиганда је повезан са паром Аг+
центара. Структура се састоји од дводимензионалних АгН
3 слојева наслаганих један на други, са слабијим Аг-Н везама између слојева. Координација Аг+
може се алтернативно описати као веома изобличена 4 + 2 октаедарска, при чему су два удаљенија атома азота део слојева изнад и испод.[13]
У својој најкарактеристичнијој реакцији, чврста супстанца се експлозивно распада, ослобађајући гас азота:
- 2 АгН
3(с) → 3 Н
2(г) + 2 Аг(с)
Први корак у овој декомпозицији је производња слободних електрона и азидних радикала; тако се брзина реакције повећава додавањем полупроводних оксида.[14] Чисти сребрни азид експлодира на 340 °Ц (644 °Ф; 613 К), али присуство нечистоћа то снижава на 270 °Ц (518 °Ф; 543 К).[15] Ова реакција има нижу енергију активације и почетно кашњење од одговарајућег разлагања азида олова.[16]
Употреба[уреди | уреди извор]
Главна препрека широкој употреби сребрног азида као примарног експлозива је његова висока цена. Пријављена је његова употреба у малим, снажним детонаторима.[17] Даље, као примарни експлозив је раније коришћена мешавина 97% експлозивне живе и 3% сребрног азида, која је имала предности оба примарна експлозива (нижа цена експлозивне живе и њена компатибилност са са бакарним омотачима лима, као и јачи почетни ефекат и могућност високих густина пуњења без губитка способности детонације), додатком сребрног азида) који се тргује под трговачким називом „Астрил“.[18] Међутим, ова примена је само од историјског интереса због општег избегавања једињења живе у технологији минирања.
Сребро азид, познат по својој високој реактивности и способности да се детонира, нашао је своју примену у различитим индустријама, али је посебно значајан у производњи детонатора и иницијатора експлозива. Његова способност да генерише брзу и снажну експлозију чини га идеалним за употребу у ситуацијама где је потребно прецизно иницирање већих експлозива.
У војним применама, сребро азид се често користи у детонаторима који активирају различите врсте муниције, од артиљеријских граната до бомби и мина. Његова брза и поуздана детонација омогућава војницима прецизно контролисање времена и места експлозије, што је од суштинског значаја за ефикасност војних операција. Осим тога, због своје стабилности при нормалним условима, сребро азид је погодан за складиштење и руковање у војним арсеналима.
У цивилној употреби, сребро азид се примењује у пиротехничкој индустрији, где се користи за иницирање ватромета и других пиротехничких ефеката. Његова способност да произведе брзу експлозију омогућава стварање спектакуларних визуелних и звучних ефеката који су кључни за пиротехничке приказе.
У области рударства и грађевинарства, сребро азид се користи за иницирање експлозива који се употребљавају за разбијање стена и других тврдих материјала. Прецизност коју пружа сребро азид омогућава контролисано рушење и смањује вероватноћу нежељених последица, као што су неконтролисане експлозије и оштећење околних структура.
Иако су његове примене широко распрострањене, производња и употреба сребровог азида су строго регулисане због његових опасних својстава. Индустрије које га користе морају се придржавати строгих безбедносних протокола како би осигурале сигурност радника и околине. Обука за руковање сребровим азидом је обавезна, а особље које га користи мора бити свесно потенцијалних ризика и способно да реагује у случају несреће.
Због своје опасности, примена сребровог азида се постепено смањује, а у неким случајевима се замењује мање опасним алтернативама. Развој нових технологија и материјала може даље смањити потребу за сребровим азидом, али његова употреба и даље остаје релевантна у одређеним специјализованим апликацијама где су његове јединствене карактеристике и даље незамењиве.
Безбедност[уреди | уреди извор]
АгН
3, као и већина азида тешких метала, је опасан примарни експлозив. Разлагање може бити изазвано излагањем ултраљубичастом светлу или ударом.[12] Церијев амонијум нитрат [НХ
4]
2[Це(НО
3)
6] се користи као оксидационо средство за уништавање АгН
3 у изливу.[15]
Општа слика безбедности у вези са сребровим азидом: Сребро азид (АгН3) је хемијски спој познат по својој високој експлозивности и осетљивости на удар, трење, топлоту и електростатски набој. Због ових својстава, руковање сребровим азидом захтева изузетан опрез и строго придржавање сигурносних протокола. У лабораторијским условима и индустријској примени, безбедност се осигурава кроз низ мера које укључују контролисано окружење, специјализовану опрему и обучено особље.
Аспекти безбедности при експериментисању: При експериментисању са сребровим азидом, важно је радити у добро вентилираној просторији или под фуме хоод-ом како би се избегло удисање штетних гасова. Лабораторијски прибор треба да буде чист и сув, без трагова других хемикалија које би могле изазвати нежељене реакције. Количине сребровог азида које се користе у експериментима требају бити минималне и руковане с великом пажњом. Експерименти се обављају иза заштитних баријера или користећи даљинске манипулаторе.
Руковање и складиштење: Руковање сребровим азидом захтева употребу одговарајуће заштитне опреме, укључујући заштитне наочаре, рукавице отпорне на хемикалије, лабораторијски мантил и, у неким случајевима, респиратор. Сребро азид се чува у стабилним условима, далеко од извора топлоте, искри и директног сунчевог светла, као и од материјала који могу изазвати трење или удар. Складиштење се врши у посебним контејнерима који су јасно означени и изоловани од других материјала.
Транспорт: Транспорт сребровог азида је такође критичан аспект безбедности. Мора се осигурати да се транспортује у складу са прописима за опасне материјале, укључујући одговарајуће означавање, паковање и документацију. Транспорт се обично врши у малим количинама, унутар отпорних и херметички затворених контејнера, а возачи и особље задужено за транспорт морају бити обучени за руковање опасним материјалима.
Одлагање: Одлагање сребровог азида мора се обавити на начин који не представља ризик за људе или околину. То обично захтева неутрализацију хемикалије под контролисаним условима, често уз помоћ квалификованих отпадних менаџмент сервиса. Отпадни материјал се третира са великим опрезом, а сви остаци се морају збринути у складу са локалним, националним и међународним прописима.
Обука и свест о ризицима: Кључни део безбедносне праксе је обука особља које рукује са сребровим азидом. Особље мора бити потпуно упознато са ризицима и процедурама у случају несреће, укључујући прву помоћ и евакуацију. Редовне обуке и симулације несрећа могу помоћи у очувању високог нивоа свести о безбедности.
Закључак: Сребро азид је материјал који захтева висок ниво опреза и строгу примену безбедносних мера. Ове мере обухватају све аспекте руковања, од лабораторијског експериментисања до складиштења, транспорта и одлагања. Правилна обука и свест о опасностима које овај материјал носи су кључни за спречавање несрећа и заштиту како људи, тако и околине.
Утицај сребровог азида на околину[уреди | уреди извор]
Сребро азид (АгН3) је хемијско једињење које, иако корисно у одређеним апликацијама, представља потенцијалну опасност за околину и здравље људи.
Токсичност сребровог азида: Сребро азид је токсичан за људске органе и ткива. Као и други тешки метали, сребро може бити токсично за водене организме и може се акумулирати у прехрамбеним ланцима, што може довести до дугорочних еколошких проблема. Токсични ефекти сребровог азида могу укључивати оштећење унутрашњих органа, нервног система и репродуктивних функција код изложених организама.
Експлозивна природа и ризици: Сребро азид је високо експлозивно једињење које може узроковати озбиљне експлозије чак и при малим количинама. Не само да експлозије представљају непосредну опасност за људе и инфраструктуру, већ могу имати и негативан утицај на околину, укључујући пожаре, ослобађање токсичних гасова и уништавање станишта.
Ослобађање азотних оксида: Приликом експлозије сребровог азида ослобађају се азотни гасови (Н2), који нису директно токсични за околину у облику у којем се ослобађају. Међутим, азотни оксиди који могу настати у реакцијама са кисеоником у атмосфери су загађивачи који доприносе стварању смога, киселине кише и озонског слоја, што може имати штетне ефекте на здравље људи, биљке и животиње.
Контаминација воде и тла: Ако сребро азид доспе у земљиште или водене путеве, може доћи до контаминације која може утицати на биљни и животињски свет. Сребро може бити токсично за микроорганизме у тлу, што може нарушити екосистемске процесе као што су разградња материје и циклуси хранљивих материја.
Утицај на биљни свет: Сребро и његови спојеви могу бити фитотоксични, што значи да могу инхибирати раст и развој биљака. То може довести до смањења биодиверзитета и нарушавања локалних екосистема.
Здравствени ризици за људе: Радници који рукују са сребровим азидом могу бити изложени ризику од тровања уколико дође до инхалације прашине или гасова, или ако једињење доспе на кожу. Потребно је користити одговарајућу заштитну опрему и поступке како би се смањио ризик од излагања.
Дугорочни еколошки ризици: Дугорочни утицај сребровог азида на околину зависи од количине и учесталости излагања. Акумулација сребра у околини може довести до постепеног повећања концентрација, што може имати токсичне ефекте на локалне екосистеме током времена.
Закључак: С обзиром на наведене ризике, важно је да се приликом руковања сребровим азидом примењују строге сигурносне мере, укључујући одговарајуће методе складиштења, руковања и одлагања. Такође је потребно спровести редовне еколошке процене како би се осигурало да не дође до штетног утицаја на околину и здравље људи.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ а б Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1002.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Роберт Матyáш, Јиří Пацхман (2013), Примарy Еxплосивес (на језику: немачки), Хеиделберг / Неw Yорк / Дордрецхт / Лондон: Спрингер, пп. 19 унд 93, ИСБН 978-3-642-28435-9
- ^ Тадеусз Урбаńски (1985), Цхемистрy анд Тецхнологy оф Еxплосивес (на језику: немачки), 3 (4 изд.), Оxфорд / Неw Yорк / Торонто / Сyднеy / Парис / Франкфурт: Пергамон Пресс, пп. 177 унд 182, ИСБН 0-08-010401-0
- ^ Роберт Матyáш, Јиří Пацхман (2013), Примарy Еxплосивес (на језику: немачки), Хеиделберг / Неw Yорк / Дордрецхт / Лондон: Спрингер, п. 2, ИСБН 978-3-642-28435-9
- ^ Роберт Матyáш, Јиří Пацхман (2013), Примарy Еxплосивес (на језику: немачки), Хеиделберг / Неw Yорк / Дордрецхт / Лондон: Спрингер, пп. 92–93, ИСБН 978-3-642-28435-9
- ^ Роберт Матyáш, Јиří Пацхман (2013), Примарy Еxплосивес (на језику: немачки), Хеиделберг / Неw Yорк / Дордрецхт / Лондон: Спрингер, пп. 91–92, ИСБН 978-3-642-28435-9
- ^ а б Роберт Матyас, Јири Пацхман (2013). Примарy Еxплосивес (1ст изд.). Спрингер. стр. 93. ИСБН 978-3-642-28435-9.[1]
- ^ Сцхмидт, C. L. Диннебиер, Р.; Wедиг, У.; Јансен, M. (2007). „Црyстал Струцтуре анд Цхемицал Бондинг оф тхе Хигх-Температуре Пхасе оф АгН3”. Инорганиц Цхемистрy. 46 (3): 907—916. ПМИД 17257034. дои:10.1021/иц061963н.
- ^ Андреw Кноx Галwеy; Мицхаел Е. Броwн (1999). Тхермал децомпоситион оф иониц солидс (вол.86 оф Студиес ин пхyсицал анд тхеоретицал цхемистрy. Елсевиер. стр. 335. ИСБН 978-0-444-82437-0.
- ^ а б Маргарет-Анн Армоур (2003). Хазардоус лабораторy цхемицалс диспосал гуиде, Енвиронментал Цхемистрy анд Тоxицологy (3рд изд.). ЦРЦ Пресс. стр. 452. ИСБН 978-1-56670-567-7.
- ^ Јехуда Yинон; Схмуел Зитрин (1996). Модерн Метходс анд Апплицатионс ин Аналyсис оф Еxплосивес. Јохн Wилеy анд Сонс. стр. 15–16. ИСБН 978-0-471-96562-6.
- ^ Тадеусз Урбаńски (1984), Цхемистрy анд Тецхнологy оф Еxплосивес (на језику: немачки), 4, Оxфорд / Неw Yорк / Торонто / Сyднеy / Парис / Франкфурт: Пергамон Пресс, пп. 485–486, ИСБН 0-08-026206-6
- ^ Роберт Матyáш, Јиří Пацхман (2013), Примарy Еxплосивес (на језику: немачки), Хеиделберг / Неw Yорк / Дордрецхт / Лондон: Спрингер, п. 94, ИСБН 978-3-642-28435-9
Литература[уреди | уреди извор]
- Холлеман А. Ф.; Wиберг Е. (2001). Инорганиц Цхемистрy (1ст изд.). Сан Диего: Ацадемиц Пресс. ИСБН 0-12-352651-5.
- Хоусецрофт, C. Е.; Схарпе, А. Г. (2008). Инорганиц Цхемистрy (3. изд.). Прентице Халл. ИСБН 978-0-13-175553-6.
Спољашње везе[уреди | уреди извор]