Водонична веза
Ван дер Валсова интеракција
|


Водонична веза (H-веза) је врста међумолекулске интеракције засноване на електростатичком привлачењу између атома водоника и неког нуклеофилног атома који садржи слободне електронске парове. Ова веза је могућа када је водоник повезан ковалентном везом са атомом велике електронегативности (нпр. кисеоник, флуор, азот) при чему се парцијално наелектрисање јако делокализује на крајевима малих, компактних молекула овог типа. Иако компаративно слаба, водонична веза је око 5 пута јача од других, стандардних интеракција типа дипол-дипол.
Другим речима, Н-веза је енталпијски повољан, квази-линеарни водонични мост између два негативно поларизована неводонична атома, који доводи језгра неводоничних атома на растојање мање од збира хемијске везе донора и водоника и одговарајућих ван дер Валсових радијуса.[4]
- H-O-H…OH2 – водонична веза између два молекула воде
- O=C(R')-N(R)-H…O=C(R')-N(R)-H – водонична веза између пептида.
Водоничне везе могу да буду интермолекуларне (јављају се између засебних молекула) или интрамолекуларне (везе између делова истог молекула).[5] У зависности од природе атома донора и акцептора који сачињавају везу, њихове геометрија и окружења, енергија водоничне везе може да варира између 1 и 40 kcal/mol.[6] То их чини донекле јачим од ван дер Валсових интеракција, и слабијим од потпуних ковалентних или јонских веза. Овај тип везе се може јавити у неорганским молекулима као што је вода и у органским молекулима попут ДНК и протеина.
Интермолекуларне водоничне везе су одговорне за високу тачку кључања воде (100 °C) у поређењу са другим хидридима 16 групе који имају знатно слабије водоничне везе.[7] Интрамолекуларно водонично везивање је делом одговорно за секундарне и терцијарне структуре протеина и нуклеинских киселина. Оно исто тако игра улогу у структури полимера, синтетичких и природних.
Године 2011, једна Иупакова радна група је препоручила модерну дефиницију водоничног везивања базирану на евиденцији, која је објављена IUPAC часопису Pure and Applied Chemistry. Та дефиниција специфицира:
Водонична веза је привлачна интеракција између атома водоника са молекула или молекуларног фрагмента X–H у којој је X електронегативнији од H, и атома или групе атома у истом или различитом молекулу, код којих постоје докази о формирању везе.[8]
Везивање[уреди | уреди извор]


Дефиниције и опште карактеристике[уреди | уреди извор]
Атом водоника везан за релативно електронегативни атом је донор водоничне везе.[10] C-H везе једино учествују у водоничном везивању кад је атом водоника везан за електронегативне супституенте, као што је случај у хлороформу, CHCl3.[11] У водоничној вези, електронегативни атом који није ковалентно везан за водоник се назива протонски акцептор, док се онај који је ковалентно везан за водоник назива протонским донором. У донорском молекулу, H центар је протичан. Донор је Луисова ваза. Водоничне везе се представљају као H···Y систем, при чему тачке представљају водоничне везе. Течности који испољавају водонично везивање (као што је вода) се називају ацоцираним течностима.
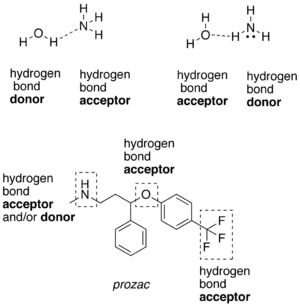

Водонична веза се често представља као електростатичка дипол-дипол интеракција. Међутим, она исто тако има нека својства ковалентног везивања: она је усмерена и јака, производи интератомска растојања краћа од суме ван дер Валсових радијуса, и обично у њој учествује ограничен број интеракционих партнера, што се може интерпретирати као вид валентности. Ова ковалентна својства су више изражена кад акцептори везују водонике са електронегативнијих донора.
Јачина везе[уреди | уреди извор]
Водоничне везе могу да варирају у јачини од слабих (1–2 kJ mol−1) до јаких (161,5 kJ mol−1 у јону HF−
2).[12][13] Типичне енталпије у пари су:
- F−H···:F (161,5 kJ/mol или 38,6 kcal/mol), илустровано јединствено са HF2−, филуорид
- O−H···:N (29 kJ/mol или 6,9 kcal/mol), илустровано паром вода-амонијак
- O−H···:O (21 kJ/mol или 5,0 kcal/mol), илустровано паровима вода-вода, алкохол-алкохол
- N−H···:N (13 kJ/mol илиr 3,1 kcal/mol), илустровано паром амонијак-амонијак
- N−H···:O (8 kJ/mol или 1,9 kcal/mol), илустровано паром вода-амид
- HO−H···: OH+
3 (18 kJ/mol[14] или 4,3 kcal/mol)
Структурни детаљи[уреди | уреди извор]
X−H растојање је типично ≈110 pm, док је H···Y растојање ≈160 до 200 pm. Типична дужина водоничне везе у води је 197 pm. Идеални угао зависи од природе донора водоничне везе. Следећи углови водоничних веза између донора флуороводоничне киселине и разних акцептора су експериментално одређени:[15]
| Акцептор···донор | VSEPR геометрија | Угао (°) |
|---|---|---|
| HCN···HF | линеарна | 180 |
| H2CO···HF | тригонално планарна | 120 |
| H2O···HF | пирамидална | 46 |
| H2S···HF | пирамидална | 89 |
| SO2···HF | тригонална | 142 |
Спектроскопија[уреди | уреди извор]
Јаке водоничне везе се препознају по низводним померањима у 1H НМР спектру. На пример, кисели прото у енолном таутомеру ацетилацетона се јавља на δ15,5, што је за око 10 ppm померено у односу на конвенционални алкохол.[16]
У ИР спектру, водонично везивање помера фреквенцију X-H истезања на нижу енергију (тј. смањује се вибрациона фреквенција). Ово померање одражава слабљење X-H везе. Поједине водоничне везе - неправилне водоничне везе - показују плаво померање фреквенције X-H истезања и смањење дужине везе.[17]
Теоријска разматрања[уреди | уреди извор]
Постоји сталан теоретски интерес у појаву водоничног везивања. Према модерном опису O:H-O интегрише интермолекуларни O:H слободни пар, „:” невезано, и интрамолекуларну H-O поларно-ковалентну везу асоцирану са O-O репулзивним спрезањем.[18]
Квантно хемијски прорачуни релевантних константи потенцијала међу остацима (константе усаглашености) указују на велике разлике између индивидуалних H веза истог типа. На пример, централна водонична веза N−H···N између остатака гуанина и цитозина је много јача у односу на N−H···N везу између пара аденин-тимин.[19]
Теоретски, јачина везе водоничних веза се може проценити користећи NCI индекс, индекс нековалентних интеракција, који омогућава визуализацију тих нековалентних интеракција, као што следи из његовог назива, користећи електронску густину система.
Из интерпретација анизотропије у Комптоновом профилу обичног леда следи да је водонична веза парцијално ковалентна.[20] Међутим, ово тумачење је оспоравано.[21]
У општијем смислу, водонична веза се може посматрати као метрички-зависно електростатичко скаларно поље између две или више интермолекуларних веза. Ово се донекле разликује од интрамолекуларних стања везивања, код на пример, ковалентних или јонских веза; међутим, водонично везивање је генерално још увек феномен стања везивања, пошто енергија интеракције има нето негативну суму. Иницијална теорија водоничног везивања коју је предложио Лајнус Полинг постулира да водоничне везе имају парцијалну ковалентну природу. Ова интерпретација је била контроверзна док помоћу НМР техника није демонстриран информациони трансфер између водонично везаних језгара, својство који је једино могуће ако водонична веза има донекле ковалентни карактер.[22]
Водонична веза у води[уреди | уреди извор]


Код молекула воде, огољени атом водоника (огољен јер је електронски облак углавном сконцентрисан око атома кисеоника) због својих малих димензија може да приђе атому кисеоника у суседном молекулу када, због различитих наелектрисања, долази до релативно јаког привлачења међу њима. Та привлачна сила је доста слабија од оне која настаје у О-Н хемијској вези, али је знатно јача од уобичајеног међумолекулског привлачења. Пошто је у највећој мери условљена димензијама и наелектрисањем водоника, та нова међумолекулска веза се назива водонична веза. Још увек се дебатује о правом карактеру водоничне везе: да ли је делимично ковалентна као ‘стандардна’ хемијска веза или је чисто електростатичка, као друге међумолекулске силе. Тај мешовити карактер чини је још увек мистериозном како за хемију тако и за физику, али и потпуно оригиналном природном појавом која се данас испитује бројним физичкохемијским методама.
Молекул воде увијек образује четири водоничне везе: две као донор (давалац) и две као акцептор (прималац) водоника. Због карактеристичне расподеле наелектрисања око атома кисеоника, водоничне везе образују тетраедар у чијем центру је атом кисеоника. У леду је такав распоред очуван кроз целу кристалну решетку, те у чврстом стању сваки молекул воде има четири водоничне везе. У течној фази, међутим, због топлотног кретања, водоничне везе се стално образују и раскидају те сваки молекул у просеку образује 3,4 водоничне везе. То значи да већина молекула образује четири водоничне везе али има и оних са три (или мање). Молекули са мање од четири везе не морају бити у тетраедарском распореду у односу на околне молекуле те су, шупљине настале правилним тетраедарским уређењем, делимично попуњене. То доводи до повећања броја молекула по јединици запремине, т. ј., до пораста густине течности у односу на кристал. Дакле, аномална промена густине (пораст густине при топљењу леда) објашњава се смањењем броја водоничних веза у течности у односу на кристал. Због тога лед плива по површини воде а вода у природи мрзне од површине ка дну. Тиме се и при највећим хладноћама спречава комплетно мржњење великих водених маса (река, језера, мора) што омогућава опстанак воденим биљкама и животињама. Међутим, иста појава, ширење воде након преласка из течне у чврсту фазу доводи до пуцања цеви и флаша са водом, хаварија на бродовима окованих ледом у северним морима, угинућа биљака и животиња након замрзавања итд. Дакле, водоничне везе нису само куриозитет физичке хемије већ микроскопска појава са великим утицајем на живот на земљи и на цивилизацију.
Полимер[уреди | уреди извор]
Полимер настаје у реакцији поливинил-алкохола и борне киселине који садрже огроман број водоничних веза. Пошто се водоничне везе лако раскидају и поново везују, полимер је веома растегљив и познат под називом гума
Водонична веза у ДНК-у[уреди | уреди извор]
Водоничне везе обезбеђују секундарну структуру ДНК и РНК. Образују се између комплементарних азотних база наспрамних ланаца ДНК, односно, наспрамно постављених делова једног ланца РНК.
Комплементарне базе у ДНК су:
- аденин и тимин повезани помоћу две водоничне везе;
- гуанин и цитозин који се повезују са три водоничне везе.
Разлика у РНК је у томе што је за аденин комплементарано везан урацил са две водоничне везе.
Природа ових везаје да су то слабе везе које се лако раскидају, али се и лако успостављају што је од великог значаја за нормално функционисање нуклеинских киселина, тиме и саме ћелије.
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ Sweetman, A. M.; Jarvis, S. P.; Sang, Hongqian; Lekkas, I.; Rahe, P.; Wang, Yu; Wang, Jianbo; Champness, N.R.; Kantorovich, L.; Moriarty, P. (2014). „Mapping the force field of a hydrogen-bonded assembly”. Nature Communications. 5: 3931. Bibcode:2014NatCo...5E3931S. PMC 4050271
 . PMID 24875276. doi:10.1038/ncomms4931.
. PMID 24875276. doi:10.1038/ncomms4931.
- ^ Hapala, Prokop; Kichin, Georgy; Wagner, Christian; Tautz, F. Stefan; Temirov, Ruslan; Jelínek, Pavel (19. 8. 2014). „Mechanism of high-resolution STM/AFM imaging with functionalized tips”. Physical Review B. 90 (8): 085421. Bibcode:2014PhRvB..90h5421H. arXiv:1406.3562
 . doi:10.1103/PhysRevB.90.085421.
. doi:10.1103/PhysRevB.90.085421.
- ^ Hämäläinen, Sampsa K.; van der Heijden, Nadine; van der Lit, Joost; den Hartog, Stephan; Liljeroth, Peter; Swart, Ingmar (31. 10. 2014). „Intermolecular Contrast in Atomic Force Microscopy Images without Intermolecular Bonds”. Physical Review Letters. 113 (18): 186102. Bibcode:2014PhRvL.113r6102H. PMID 25396382. doi:10.1103/PhysRevLett.113.186102. Архивирано из оригинала 20. 01. 2018. г. Приступљено 05. 02. 2019.
- ^ S. K. Burley, G. A. Petsko, Adv.Prot.Chem. 39, 125-189 (1988)
- ^ IUPAC. „hydrogen bond”. Kompendijum hemijske terminologije (Internet izdanje).
- ^ Steiner, Thomas (2002). „The Hydrogen Bond in the Solid State”. Angew. Chem. Int. Ed. 41: 48—76. doi:10.1002/1521-3773(20020104)41:1<48::AID-ANIE48>3.0.CO;2-U.
- ^ Sabin, John R. (1971). „Hydrogen bonds involving sulfur. I. Hydrogen sulfide dimer”. J. Am. Chem. Soc. 93 (15): 3613—3620. doi:10.1021/ja00744a012.
- ^ Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J.; Hobza, Pavel; Kjaergaard, Henrik G.; Legon, Anthony C.; Mennucci, Benedetta; Nesbitt, David J. (2011). „Definition of the hydrogen bond”. Pure Appl. Chem. 83 (8): 1637—1641. doi:10.1351/PAC-REC-10-01-02.
- ^ Beijer, Felix H.; Kooijman, Huub; Spek, Anthony L.; Sijbesma, Rint P.; Meijer, E. W. (1998). „Self-Complementarity Achieved through Quadruple Hydrogen Bonding”. Angew. Chem. Int. Ed. 37 (1–2): 75—78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ^ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Архивирано из оригинала 2. 11. 2014. г.
- ^ Wiley, G.R.; Miller, S.I. (1972). „Thermodynamic parameters for hydrogen bonding of chloroform with Lewis bases in cyclohexane. Proton magnetic resonance study”. Journal of the American Chemical Society. 94 (10): 3287. doi:10.1021/ja00765a001.
- ^ Larson, J. W.; McMahon, T. B. (1984). „Gas-phase bihalide and pseudobihalide ions. An ion cyclotron resonance determination of hydrogen bond energies in XHY- species (X, Y = F, Cl, Br, CN)”. Inorganic Chemistry. 23 (14): 2029—2033. doi:10.1021/ic00182a010.
- ^ Emsley, J. (1980). „Very Strong Hydrogen Bonds”. Chemical Society Reviews. 9 (1): 91—124. doi:10.1039/cs9800900091.
- ^ Data obtained using molecular dynamics as detailed in the reference and should be compared to 7.9 kJ/mol for bulk water, obtained using the same calculation.Markovitch, Omer; Agmon, Noam (2007). „Structure and energetics of the hydronium hydration shells” (PDF). J. Phys. Chem. A. 111 (12): 2253—2256. Bibcode:2007JPCA..111.2253M. CiteSeerX 10.1.1.76.9448
 . PMID 17388314. doi:10.1021/jp068960g. Архивирано из оригинала (PDF) 13. 08. 2014. г. Приступљено 05. 02. 2019.
. PMID 17388314. doi:10.1021/jp068960g. Архивирано из оригинала (PDF) 13. 08. 2014. г. Приступљено 05. 02. 2019.
- ^ Legon, A. C.; Millen, D. J. (1987). „Angular geometries and other properties of hydrogen-bonded dimers: a simple electrostatic interpretation of the success of the electron-pair model”. Chemical Society Reviews. 16: 467. doi:10.1039/CS9871600467.
- ^ Friebolin, H., "Basic One- and Two- Dimensional NMR Spectroscopy, 4th ed.," VCH: Weinheim. 2008. ISBN 978-3-527-31233-7.
- ^ Hobza P, Havlas Z (2000). „Blue-Shifting Hydrogen Bonds”. Chem. Rev. 100 (11): 4253—4264. PMID 11749346. doi:10.1021/cr990050q.
- ^ Sun, C. Q.; Sun, Yi (2016). The Attribute of Water: Single Notion, Multiple Myths. ISBN 978-981-10-0178-9.
- ^ Grunenberg, Jörg (2004). „Direct Assessment of Interresidue Forces in Watson−Crick Base Pairs Using Theoretical Compliance Constants”. Journal of the American Chemical Society. 126 (50): 16310—1. PMID 15600318. doi:10.1021/ja046282a.
- ^ Isaacs, E.D.; et al. (1999). „Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement”. Physical Review Letters. 82 (3): 600—603. Bibcode:1999PhRvL..82..600I. doi:10.1103/PhysRevLett.82.600.
- ^ Ghanty, Tapan K.; Staroverov, Viktor N.; Koren, Patrick R.; Davidson, Ernest R. (1. 2. 2000). „Is the Hydrogen Bond in Water Dimer and Ice Covalent?”. Journal of the American Chemical Society. 122 (6): 1210—1214. ISSN 0002-7863. doi:10.1021/ja9937019.
- ^ Cordier, F; Rogowski, M; Grzesiek, S; Bax, A (1999). „Observation of through-hydrogen-bond (2h)J(HC') in a perdeuterated protein”. J Magn Reson. 140 (2): 510—2. Bibcode:1999JMagR.140..510C. PMID 10497060. doi:10.1006/jmre.1999.1899.
Литература[уреди | уреди извор]
- Sun, C. Q.; Sun, Yi (2016). The Attribute of Water: Single Notion, Multiple Myths. ISBN 978-981-10-0178-9.
- Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Архивирано из оригинала 2. 11. 2014. г.
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA. 1997. ISBN 978-0-19-509549-4.
Спољашње везе[уреди | уреди извор]
- The Bubble Wall (Audio slideshow from the National High Magnetic Field Laboratory explaining cohesion, surface tension and hydrogen bonds)
- isotopic effect on bond dynamics

