Lučenje
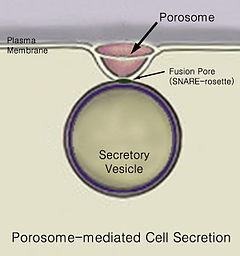
Lučenje je kretanje materijala iz jednog mesta u drugo, npr. lučenje hemijske supstance iz ćelije ili žlezde. Slično tome, izlučivanje je uklanjanje određenih supstanci ili otpadnih proizvoda iz ćelije ili organizma. Uobičajeni mehanizam ćelijskog lučenja je putem sekretornih kanala na ćelijskoj membrani, zvanih porozomi.[1] Porozomi su permanentne lipoproteinske strukture u obliku čašice na membrani. Na mestu porozoma se sekretorne vezikule fuzionišu sa ćelijskom membranom, kako bi oslobodile intravezikularni ćelijski sadržaj.
Lučenje kod bakterijskih vrsta predstavlja transport ili translokaciju efektorskih molekula, na primer: proteina, enzima ili toksina (npr. toksin kolere kod Vibrio cholerae), iz unutrašnjosti (citoplazme ili citosola) bakterijske ćelije u spoljašnjost. Lučenje je veoma važan mehanizam za prilagođavanje i preživljavanje bakterija u njihovom prirodnom okruženju.
Kod eukariotskih ćelija[uredi | uredi izvor]
Mehanizam[uredi | uredi izvor]
Eukariotske ćelije, uključujući i ljudske ćelije, imaju visoko evoluiran proces lučenja. Proteini vanćelijskog sadržaja sintetišu se pomoću ribozoma vezanih za granulirani endoplazmatski retikulum (ER). Kako se sintetišu, ovi proteini se translociraju u lumen ER, gde podležu glikozilaciji i bivaju sakupljani od strane molekularnih šaperona. Takođe, ovde se pogrešno savijani proteini identifikuju i retrotranslociraju u citosol od strane ER-asociranog sa degradacijom, gde se razgrađuju proteazama. Vezikule koje sadrže pravilno savijene proteine odlaze u Goldžijev aparat.
U Goldžijevom aparatu se glikozilacija proteina modifikuje, i može doći do dalje posttranslacione modifikacije, uključujući cepanje i funkcionalizaciju. Proteini zatim sekretornim vezikulama koji putuju duž citoskeleta do ivice ćelije. Modifikacija se može dogoditi i u sekretornim vezikulama (na primer, insulin nastaje od proinsulina u sekretornim vezikulama).
Na kraju, dolazi do fuzije vezikula sa ćelijskom membranom u strukturi koja se naziva porozom, u procesu zvanom egzocitoza, što rezultuje izbacivanjem intravezikularnog sadržaja iz ćelije.[2]
Striktna biohemijska kontrola se održava putem pH gradijenta: pH citosola je 7,4, endoplazmatičog retikuluma 7,0, a goldžijevog aparata 6,5. Sekretorne vezikule imaju pH između 5,0 i 6,0; neke sekretorne vezikule postanu lizozomi, koji imaju pH 4,8.
Neuobičajena sekrecija[uredi | uredi izvor]
Postoje mnogi proteini, poput FGF1 (aFGF), FGF2 (bFGF), interleukin 1 (IL1) i sl. koji nemaju signalnu sekvencu. Oni ne koriste klasični ER-Goldži put, već se izlučuju na različite neuobičajene načine.
Opisana su najmanje četiri puta neuobičajene (nekonvencionalne) proteinske sekrecije.[3] Oni uključuju: 1) direktnu translokaciju proteina kroz plazmamembranu verovatno putem membranskih transportera, 2) „blebing”, 3) lizozomalnu sekreciju i 4) oslobađanje putem egzozoma izvedenih od multivezikularnih tela. Pored toga, proteini se mogu oslobađati iz ćelija mehaničkim ili fiziološkim ranjavanjem[4] i preko neletalnih, prolaznih onkotskih pora u plazma membrani, indukovanih ispiranjem ćelija sa medijumom ili puferima bez seruma.[5]
U ljudskim tkivima[uredi | uredi izvor]
Mnogi tipovi ljudskih ćelija imaju sposobnost da budu sekretorne ćelije, jer imaju dobro razvijen endoplazmatički retikulum i Goldžijev aparat. Tkiva kod ljudi koja stvaraju izlučevine uključuju: gastrointestinalni trakt koji izlučuje digestivne enzime i želudačnu kiselinu, pluća koja luče surfaktante, i lojne žlezde koje luče sebum za podmazivanje kože i kose.
Kod gram-negativnih bakterija[uredi | uredi izvor]
Sekrecija nije svojstvena samo za eukariote, već je prisutna i u bakterijama i arheama. ABC transporteri (ATP binding cassette) zajednički su za sva tri domena živog sveta. Neki izlučeni proteini se translociraju preko plazmamembrane pomoću Sec translocon-a, jednog od dva sistema translokacije, za koji je potrebno prisustvo N-terminalnog signalnog peptida na izlučenom proteinu. Ostali se translociraju preko citoplazmatske membrane putem dvostruko-argininske translokacije (Tat). Gram-negativne bakterije imaju dve membrane, što izlučivanje čini kompleksnijim. Postoji najmanje šest specijalizovanih sistema za izlučivanje kod gram-negativnih bakterija. Mnogi izlučeni proteini su posebno važni u bakterijskoj patogenezi.[6]
Sistem lučenja tipa I (T1SS ili TOSS)[uredi | uredi izvor]
Lučenje tipa I je sistem koji zavisi od šaperona i koji koristi Hly i Tol gen klastere. Proces započinje nakon prepoznavanja vodeće HlyА sekvence i vezivanja za HlyB sa membrane. Ova signalna sekvenca je izuzetno specifična za ABC transporter. Zatim HlyAB kompleks stimuliše HlyD, koji počinje da se odvaja i dospeva na spoljašnju membranu, Signal na HlyD ili terminalni molekul, prepoznaje TolC. Zapravo, HlyD regrutuje TolC na unutrašnju membranu, a HlyA se izlučuje izvan spoljašnje membrane preko proteinskog kanala dugog tunela.
Sistem tipa I prenosi razne molekule, od jona, lekova, do proteina različite veličine (20—900 kDa). Molekuli koji se izlučuju variraju u veličini, od malog peptida kolicina V (10 kDа, Escherichia coli), do ćelijskog adhezinog proteina LapA (520 kDа, Pseudomonas fluorescens). [7] Najbolje su okarakterisani RTX toksini i lipaze. Lučenje tipa I takođe je uključeno u izvoz neproteinskih supstrata, poput cikličnih β-glukana i polisaharida.
Sistem lučenja tipa II (T2SS)[uredi | uredi izvor]
Proteini koji se luče sistemom tipa II, ili glavnim terminalnim ogrankom opšte sekrecije, zavise od Sec ili Tat sistema za inicijalni transport u periplazmu. Kad dospeju tamo, oni prolaze kroz spoljašnju membranu preko multisubjediničnog (12–14 subjedinica) kompleksa pore, formirajući proteine sekreta. Pored proteina sekreta, 10–15 drugih proteina unutrašnje i spoljašnje membrane čine kompletni sekretorni aparat, od kojih su mnogi i dalje nepoznate funkcije. Gram-negativni pili tipa IV koriste modifikovanu verziju sistema tipa II za svoju biogenezu. U nekim slučajevima, određeni proteini se dele između sloja pilusa i sistema tipa II, unutar jedne bakterijske vrste.
Sistem lučenja tipa III (T3SS ili TTSS)[uredi | uredi izvor]
Sistem lučenja tipa III homolog je bazalnom telu u bakterijskim bičevima (flagelama). Nalik je molekularnom špricu, kroz koji bakterija (neke vrste, npr. Salmonella, Shigella, Yersinia, Vibrio) može ubrizgati proteine u eukariotske ćelije. Niska koncentracija Ca2+ u citosolu, dovodi do otvaranja kanala koji reguliše T3SS. Jedan takav mehanizam, ilustrovan je LcrV (engl. Low Calcium Response) antigenom (upotrebnjenim od Yersinia pestis), koji detektuje nisku koncentraciju kalcijuma i izaziva T3SS vezanost. Sličnim mehanizmom, Hrp sistem biljnih patogena ubrizgava harpine i patogene efektorske proteine u biljke. Ovaj sistem lučenja prvi put je otkriven kod Yesinia pesis i pokazao je da se toksini mogu ubrizgati direktno iz bakterijske citoplazme u citoplazmu ćelija domaćina, a ne da se jednostavno izlučuju u vanćelijski medijum.[8]
Sistem lučenja tipa IV (T4SS ili TFSS)[uredi | uredi izvor]
Sistem lučenja tipa IV xomolog je aparatu za konjugaciju bakterija. Ovaj sistem je sposoban da transportuje i DNK i proteine. Otkriven je kod Agrobacterium tumefaciens, koja koristi ovaj sistem za uvođenje T-DNK dela Ti plazmida, u biljnog domaćina, što uzrokuje razviće pogođenog područja u žučnu krunu (tumor). Helicobacter pylori koristi sistem lučenja tipa IV za isporuku CagA u ćelije epitela želuca, koji je povezan sa karcinogenezom želuca.[9] Bordetella pertussis, uzročnik magarećeg kašlja, luči pertuzijski toksin delom kroz sistem tipa IV. Legionella pneumophila, uzročnik legioneloze (Legionarska bolest) koristi sistem lučenja tipa IVB, poznat kao icm/dot sistem (intracellular multiplication / defect in organelle trafficking genes), za translociranje brojnih efektorskih proteina u svog eukariotskog domaćina.[10] Prototip sistema za lučenje tipa IVA je VirB kompleks Agrobacterium tumefaciens.[11]
Članovi proteina ove porodice su komponente sistema lučenja tipa IV. Oni posreduju u unutarćelijskom prenosu makromolekula, preko mehanizma koji je prethodno povezan sa mehanizmom konjugacije bakterija.[12] [13]
Funkcija[uredi | uredi izvor]
Ukratko, sistem lučenja tipa IV (Т4SS) je opšti mehanizam kojim bakterijske ćelije izlučuju ili preuzimaju makromolekule. Njihov precizan mehanizam za sada je nepoznat. Т4SS je kodiran na gram-negativnim konjugacijskim elementima u bakterijama. Т4SS je kompleks kroz ćelijsku membranu ili, drugim rečima, 11–13 jezgra proteina koji formiraju kanal kroz koji DNK i proteini mogu da putuju od citoplazme donatorske ćelije do citoplazme ćelije primaoca. Pored toga, Т4SS luči proteine - faktore virulencije direktno u ćelije domaćina, ali i preuzima DNK iz medijuma prirodnom transformacijom, što pokazuje svestranost ovog makromolekularnog aparata.[14]
Interakcije[uredi | uredi izvor]
Т4SS ima dva efektorska proteina: prvo, АТS-1, što je označava analazma translocirani supstrat 1, i drugo AnkA, što označava protein koji sadrži ankirin ponovljeni domen sa proteinom A. Pored toga, proteini koji spajaju Т4SS su VirD4 vezan za VirE2.[15]
Sistem lučenja tipa V (Т5SS)[uredi | uredi izvor]
Sitem lučenja tipa V takođe zovemo i sistem autotransportera.[16] Ovaj sistem lučenja uključuje korišćenje Sec sistema za prolazak kroz unutrašnju membranu. Proteini koji se luče na ovaj način, imaju mogućnost da formiraju beta barel sa svojim C-terminusom, koji se ubacuje u spoljašnju membranu omogućavajući ostatku peptida (putnički domen) da dospe van ćelije. Često se autotransporteri cepaju, ostavljajući beta barel domen u spoljašnjoj membrani, uz oslobađanje putničkog domena. Neki istraživači veruju da su upravo ovi ostaci autotransportera stvorili porine. koji formiraju slične beta barel strukture. Uobičajeni primer autotransportera, koji koristi ovaj sistem lučenja, jeste trimerski autotransporter adheziv (ТАА).[17]
Sistem lučenja tipa VI (Т6SS)[uredi | uredi izvor]
Sistem lučenja tipa VI je identifikovan 2006. godine od strane Džona Mekalanosa sa saradnicima (Medicinska škola Harvard, Boston, SAD), kod dva bakterijska patogena, Vibrio cholerae i Pseudomonas aeruginosa.[18] [19] Oni su identifikovani kada su mutacije gena Hcp i VrgG, kod Vibrio cholerae, dovele do smanjenja virulencije i patogenosti. Kasnije, sistem lučenja tipa VI pronađen je u četvrtini svih proteobakterijskih genoma, uključujući životinjske, biljne i ljudske patogene, kao i zemljišne, ekološke i morske bakterije.[20] [21] Dok se većina ranih istraživanja sekrecije lučenja tipa VI fokusirala na njegovu ulogu u patogenezi viših organizama, novije studije sugerisale su njegovu fiziološku ulogu u odbrani od jednostavnih eukariotskih predatora i ulogu u bakterijskim interakcijama.[22] [23] Genski klasteri sistema tipa VI sadrže od 15 do više od 20 gena, od kojih su se dva, Hcp i VgrG, pokazala kao gotovo univerzalni sekretorni supstrati sistema. Struktura ovih, i drugih proteina u ovom sistemu, ima upečatljivu sličnost sa vrhom flagele T4 faga, a smatra se da aktivnost sistema funkcionalno podseća na fago infekciju.[24]
Oslobađanje vezikula od spoljašnje membrane[uredi | uredi izvor]
Pored upotrebe prethodno navedenih multiproteinskih kompleksa, gram-negativne bakterije poseduju i drugu metodu za oslobađanje materijala - formiranje bakterijskih vezikula od spoljašnje membrane.[25] Delovi spoljašnje membrane se odvajaju, formirajući sferne strukture nanometarskih razmera izgrađene od lipidnog dvosloja, bogatog lipopolisaharidom koji obuhvata periplazmatski materijal. Ovakve strukture služe za membranski vezikularni transport, radi manipulacije okolinom ili invazije na domaćin-patogen vezu. Otkriveno je da vezikule mnogih bakterijskih vrsta sadrže faktore virulencije, neke imaju imunomodulatorne efekte, dok druge mogu direktno da prijanjaju i zaraze ćelije domaćina. Otpuštanje vezikula pokazalo se kao opšti odgovor na stresne uslove, a čini se da je postupak "pakovanja" proteina selektivan.[26]
Kod gram-pozitivnih bakterija[uredi | uredi izvor]
Kod nekih vrsta rodova Staphylococcus i Streptococcus, pomoćni sistem lučenja upravlja izvozom mnogobrojnih adhezivnih glikoproteina.
Vidi još[uredi | uredi izvor]
Reference[uredi | uredi izvor]
- ^ Lee, Jin-Sook; Jeremic, Aleksandar; Shin, Leah; Cho, Won Jin; Chen, Xuequn; Jena, Bhanu P. (jul 2012). „Neuronal porosome proteome: Molecular dynamics and architecture”. Journal of Proteomics. 75 (13): 3952—62. PMC 4580231
 . PMID 22659300. doi:10.1016/j.jprot.2012.05.017.
. PMID 22659300. doi:10.1016/j.jprot.2012.05.017.
- ^ Anderson, L. L. (2006). „Discovery of the 'porosome'; the universal secretory machinery in cells”. Journal of Cellular and Molecular Medicine. 10 (1): 126—31. PMC 3933105
 . PMID 16563225. doi:10.1111/j.1582-4934.2006.tb00294.x.
. PMID 16563225. doi:10.1111/j.1582-4934.2006.tb00294.x.
- ^ Nickel, Walter; Seedorf, Matthias (2008). „Unconventional mechanisms of protein transport to the cell surface of eukaryotic cells”. Annual Review of Cell and Developmental Biology. 24: 287—308. PMID 18590485. doi:10.1146/annurev.cellbio.24.110707.175320.
- ^ McNeil, Paul L.; Steinhardt, Richard A. (2003). „Plasma membrane disruption: repair, prevention, adaptation”. Annual Review of Cell and Developmental Biology. 19: 697—731. PMID 14570587. doi:10.1146/annurev.cellbio.19.111301.140101.
- ^ Chirico, William J. (oktobar 2011). „Protein release through nonlethal oncotic pores as an alternative nonclassical secretory pathway”. BMC Cell Biology. 12: 46. PMC 3217904
 . PMID 22008609. doi:10.1186/1471-2121-12-46
. PMID 22008609. doi:10.1186/1471-2121-12-46  .
.
- ^ Wooldridge, K, ur. (2009). Bacterial Secreted Proteins: Secretory Mechanisms and Role in Pathogenesis. Caister Academic Press. ISBN 978-1-904455-42-4.
- ^ Boyd, Chelsea D.; Smith, T. Jarrod; El-Kirat-Chatel, Sofiane; Newell, Peter D.; Dufrêne, Yves F.; O'Toole, George A. (avgust 2014). „Structural features of the Pseudomonas fluorescens biofilm adhesin LapA required for LapG-dependent cleavage, biofilm formation, and cell surface localization”. Journal of Bacteriology. 196 (15): 2775—88. PMC 4135675
 . PMID 24837291. doi:10.1128/JB.01629-14.
. PMID 24837291. doi:10.1128/JB.01629-14.
- ^ Salyers, A. A. & Whitt, D. D. (2002). Bacterial Pathogenesis: A Molecular Approach (2nd izd.). Washington, D.C.: ASM Press. ISBN 1-55581-171-X.
- ^ Hatakeyama, Masanori; Higashi, Hideaki (decembar 2005). „Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis”. Cancer Science. 96 (12): 835—43. PMID 16367902. S2CID 5721063. doi:10.1111/j.1349-7006.2005.00130.x.
- ^ Cascales, Eric; Christie, Peter J. (novembar 2003). „The versatile bacterial type IV secretion systems”. Nature Reviews. Microbiology. 1 (2): 137—49. PMC 3873781
 . PMID 15035043. doi:10.1038/nrmicro753.
. PMID 15035043. doi:10.1038/nrmicro753.
- ^ Christie, Peter J.; Atmakuri, Krishnamohan; Krishnamoorthy, Vidhya; Jakubowski, Simon; Cascales, Eric (2005). „Biogenesis, architecture, and function of bacterial type IV secretion systems”. Annual Review of Microbiology. 59: 451—85. PMC 3872966
 . PMID 16153176. doi:10.1146/annurev.micro.58.030603.123630.
. PMID 16153176. doi:10.1146/annurev.micro.58.030603.123630.
- ^ Christie, Peter J. (novembar 2004). „Type IV secretion: the Agrobacterium VirB/D4 and related conjugation systems”. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1694 (1–3): 219—34. PMC 4845649
 . PMID 15546668. doi:10.1016/j.bbamcr.2004.02.013.
. PMID 15546668. doi:10.1016/j.bbamcr.2004.02.013.
- ^ Yeo, Hye-Jeong; Yuan, Qing; Beck, Moriah R.; Baron, Christian; Waksman, Gabriel (decembar 2003). „Structural and functional characterization of the VirB5 protein from the type IV secretion system encoded by the conjugative plasmid pKM101”. Proceedings of the National Academy of Sciences of the United States of America. 100 (26): 15947—52. Bibcode:2003PNAS..10015947Y. JSTOR 3149111. PMC 307673
 . PMID 14673074. doi:10.1073/pnas.2535211100
. PMID 14673074. doi:10.1073/pnas.2535211100  .
.
- ^ Lawley, T.D; Klimke, W.A; Gubbins, M.J; Frost, L.S (jul 2003). „F factor conjugation is a true type IV secretion system”. FEMS Microbiology Letters. 224 (1): 1—15. PMID 12855161. S2CID 3398753. doi:10.1016/S0378-1097(03)00430-0.
- ^ Rikihisa, Y.; Lin, M.; Niu, H. (septembar 2010). „Type IV secretion in the obligatory intracellular bacterium Anaplasma phagocytophilum”. Cellular Microbiology. 12 (9): 1213—21. PMC 3598623
 . PMID 20670295. doi:10.1111/j.1462-5822.2010.01500.x.
. PMID 20670295. doi:10.1111/j.1462-5822.2010.01500.x.
- ^ Thanassi, David G.; Stathopoulos, Christos; Karkal, Aarthi; Li, Huilin (2005). „Protein secretion in the absence of ATP: the autotransporter, two-partner secretion and chaperone/usher pathways of gram-negative bacteria (review)”. Molecular Membrane Biology. 22 (1–2): 63—72. PMID 16092525. S2CID 2708575. doi:10.1080/09687860500063290.
- ^ Gerlach, R.; Hensel, M. (oktobar 2007). „Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens”. International Journal of Medical Microbiology. 297 (6): 401—15. PMID 17482513. doi:10.1016/j.ijmm.2007.03.017.
- ^ Pukatzki, Stefan; Ma, Amy T.; Sturtevant, Derek; Krastins, Bryan; Sarracino, David; Nelson, William C.; Heidelberg, John F.; Mekalanos, John J. (januar 2006). „Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system”. Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1528—33. Bibcode:2006PNAS..103.1528P. JSTOR 30048406. PMC 1345711
 . PMID 16432199. doi:10.1073/pnas.0510322103
. PMID 16432199. doi:10.1073/pnas.0510322103  .
.
- ^ Mougous, Joseph D.; Cuff, Marianne E.; Raunser, Stefan; Shen, Aimee; Zhou, Min; Gifford, Casey A.; Goodman, Andrew L.; Joachimiak, Grazyna; OrdoñEz, Claudia L.; Lory, Stephen; Walz, Thomas; Joachimiak, Andrzej; Mekalanos, John J. (jun 2006). „A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus”. Science. 312 (5779): 1526—30. Bibcode:2006Sci...312.1526M. PMC 2800167
 . PMID 16763151. doi:10.1126/science.1128393.
. PMID 16763151. doi:10.1126/science.1128393.
- ^ Bingle, Lewis EH; Bailey, Christopher M.; Pallen, Mark J. (februar 2008). „Type VI secretion: a beginner's guide” (PDF). Current Opinion in Microbiology. 11 (1): 3—8. PMID 18289922. doi:10.1016/j.mib.2008.01.006.
- ^ Cascales, Eric (avgust 2008). „The type VI secretion toolkit”. EMBO Reports. 9 (8): 735—41. PMC 2515208
 . PMID 18617888. doi:10.1038/embor.2008.131.
. PMID 18617888. doi:10.1038/embor.2008.131.
- ^ Schwarz, Sandra; Hood, Rachel D.; Mougous, Joseph D. (decembar 2010). „What is type VI secretion doing in all those bugs?”. Trends in Microbiology. 18 (12): 531—7. PMC 2991376
 . PMID 20961764. doi:10.1016/j.tim.2010.09.001.
. PMID 20961764. doi:10.1016/j.tim.2010.09.001.
- ^ Coulthurst, Sarah J. (2013). „The Type VI secretion system - a widespread and versatile cell targeting system”. Research in Microbiology. 164 (6): 640—54. PMID 23542428. doi:10.1016/j.resmic.2013.03.017.
- ^ Silverman, Julie M.; Brunet, Yannick R.; Cascales, Eric; Mougous, Joseph D. (2012). „Structure and regulation of the type VI secretion system”. Annual Review of Microbiology. 66: 453—72. PMC 3595004
 . PMID 22746332. doi:10.1146/annurev-micro-121809-151619.
. PMID 22746332. doi:10.1146/annurev-micro-121809-151619.
- ^ Kuehn, Meta J.; Kesty, Nicole C. (novembar 2005). „Bacterial outer membrane vesicles and the host-pathogen interaction”. Genes & Development. 19 (22): 2645—55. PMID 16291643. doi:10.1101/gad.1299905.
- ^ McBroom, Amanda J.; Kuehn, Meta J. (januar 2007). „Release of outer membrane vesicles by Gram-negative bacteria is a novel envelope stress response”. Molecular Microbiology. 63 (2): 545—58. PMC 1868505
 . PMID 17163978. doi:10.1111/j.1365-2958.2006.05522.x.
. PMID 17163978. doi:10.1111/j.1365-2958.2006.05522.x.
Literatura[uredi | uredi izvor]
- Alberts B, Johnson A, Lewix J, Raff M, Roberts K, Walter P, eds. (2002). "Search: Secretion". Molecular Biology of the Cell (4th ed.) New York: Garland Science. ISBN 978-0-8153-3218-3.
- Whide D. (2000). The physiology and biochemistry of prokaryotes (2nd izd.). Oxford University Press. ISBN 978-0-19-512579-5.
- Avon D. "Home page". Cells alive!.
Spoljašnje veze[uredi | uredi izvor]
- Secretions at the US National Library of Medicine Medical Subject Headings (MeSH)
- Ilustracija T5SS / autotransportera na Uni Münster
