Батерија

У науци и технологији, батерија је електрохемијски уређај у коме је ускладиштена хемијска енергија (у виду потенцијалне енергије), која се може претворити у електричну енергију када се крајеви батерије, електроде, споје проводником. Батерија је уређај који се састоји од једне или више електрохемијских ћелија са спољним прикључцима за напајање електричних уређаја као што су батеријске лампе, паметни телефони, и електрична кола.[1] Кад батерија пружа електричну снагу, њен позитивни прикључак је катода, а њен негативни прикључак је анода.[2] Терминал означен као негативан је извор електрона који ће тећи кроз спољашње електрично коло до позитивног терминала. Катода и анода дакле, међусобно повезани преко спољног кола, представљају медијум за пренос наелектрисања и при томе учествују у редокс реакцијама као активне масе. Pедокс процеси - процеси који дају енергију, одвијају се на граници фазе електрода/електролит, док се електрони (ослобођени из аноде током реакција оксидације) транспортују кроз спољни електрични круг (до катоде) стварајући даље електричну енергије која се може користити за напајање потрошача. Другим речима, када се батерија повеже на спољашње електрично оптерећење, редокс реакција конвертује високо-енергетске реактанте у производе ниске енергије, и разлика слободне енергије се испоручује спољашњем колу као електрична енергија. Електролит је хемијскa врста којa је истовремено и електронски изолатор - физички раздваја аноду и катоду и јонски проводник - има улогу да осигура транспорт јонских врста између електрода. [3] Историјски термин „батерија” се специфично односио на уређај који се састојао од вишеструких ћелија, међутим његова употреба је еволуирала тако да сада обухвата уређаје који се састоје од једне ћелије.[4] Прва позната батерија је Багдадска батерија из периода 250. п. н. е. и 640. п. н. е. Модерне батерије раде на принципу који је изумео италијански физичар Алесандро Волта 1800. године.
Батерије спадају у такозване примарне изворе електричне енергије, јер претварају хемијску енергију у електричну и не могу се пунити (процес није реверзибилан). За разлику од батерија, акумулатор спада у секундарне електрохемијске изворе (реверзибилне) електричне енергије и може више пута претварати хемијску у електричну енергију и обрнуто (може се пунити и празнити). Други назив за батерију је примарни галвански елемент. Галвански елементи су примарни хемијски извори струје. Постоји више врста галванских елемената: Волтин, Данијелов, Лекланшов итд. Данијеловим елементом може се на једноставан начин објаснити принцип батерије. Данијелов елемент се састоји од цинкане електроде потопљене у раствор цинк-сулфата (ZnSO4) и бакарне електроде која се налази у раствору бакар-сулфата (CuSO4), једни од другог одвојени су посудом од порозног материјала кроз чије зидове могу да пролазе само јони SO4. Када се цинкана електрода стави у разблажени водени раствор цинк-сулфата атоми цинка спонтано прелазе у раствор као позитивни јони Zn2+ остављајући своја два електрона на електроди. Прелажењем јона цинка у раствор, електрода постаје негативно наелектрисана, а раствор позитивно. У врло танком пограничном слоју између цинкане електроде и раствора настаје електрично поље усмерено тако да се супротставља прелажењу јона Zn2+ у раствор. Што више јона пређе у раствор, ово поље је све јаче. Убрзо то електрично поље достиже ону вредност при којој се електрична сила изједначава са хемијском, те се даље прелажење јона Zn2+ у раствор зауставља и наелектрисање електроде и раствора се више не повећавају.
Батерије су доступне у мноштву облика и величина, од минијатурних ћелија које се користе за напајање слушних апарата и ручних сатова до малих, танких ћелија које се користе у паметним телефонима, до великих оловно киселинских батерија или литијум-јонских батерија у возилима, и у крајњем екстрему, огромне батеријске банке величине собе која пружа резервну или хитну снагу за телефонске централе и рачунарске дата центре. Према процени из 2005. године, индустрија батерија је широм света генерисала 48 америчких долара милијарди у продаји сваке године,[5] са годишњим растом од 6%.
Историја[уреди | уреди извор]
Употреба „батерије” за описивање групе електричних уређаја датира из времена Бенџамина Френклина, који је 1748. године описао вишеструке Лејденске посуде по аналогији са батеријом топова[6] (Бенџамин Френклин је позајмио термин „батерија” из војске, где се односи на оружје које заједнички дејствује[7]).
Италијански физичар Алесандро Волта израдио је и описао прву електрохемијску батерију, волтни елемент, 1800. године.[8] Она се састојала од бакарне шичке и цинкане плоче, раздвојених расолом натопљеним папирним дисковима. Она је могла да производи постојану струју током знатног временског периода. Волта није разумео да је напон последица хемијских реакција. Он је сматрао да су његове ћелије неисцрпан извор енергије,[9] и да су повезани корозиони ефекти на електродама пука непријатност, а не неизбежна последица њиховог рада, као што је то показао Мајкл Фарадеј 1834. године.[10]
Ране батерије су биле од велике важности у експерименталној примени, међутим у пракси су њихови напони флуктуирали и оне нису могле да обезбеде велику струју током дужих периода. Данијелову ћелију је измео 1836. године британски хемичар Џон Фредерик Данијел. Она је била први практични извор електирцитета, тако да је постала индустријски стандард и доживела широку адаптацију као извор напајања за мреже електричних телеграфа.[11] Она се састојала од бакарне посуде напуњене бакар сулфатним раствором, у који је био уроњен неглазирани глинени суд напуњен сумпорном киселином са цинканом електродом.[12]
Ове влажне ћелије су користиле течне електролите, те су биле склоне цурењу и просипању, ако се њима није правилно руковало. Многе су користиле стаклене посуде за држање њихових компоненти, што их је чинило крхким и потенцијално опасним. Ове карактеристике су учиниле влажне челије неподобним за портабилне видове примене. При крају деветнаестог века, изум батерија са сувим ћелијама, у којима су течни електролити замењени пастом, учинио је практичним портабилне електричне уређаје.[13]
Лекланшов чланак[уреди | уреди извор]
Постоје разни уређаји који имају способност да на једном (негативном) прикључку нагомилају слободне електроне, који зато недостају на другом крају уређаја или позитивном прикључку. Такав учинак може се постићи на пример физичко-хемијским реакцијама у тзв. Лекланшовом чланку, који је боље познат под изразом батеријски чланак или батерија.[14][15][16] Лекланшов чланак је врста галванског чланка који је добио име по француском електричару Жоржу Лекланшу. Она се састоји од суда од цинка у који се смјешта хемијски активна материја - тзв. електролит и у њему уроњен угљена шипка. Такав чланак захваљујући физичко-хемијским процесима у електролиту ствара разлику потенцијала од 1,5 V на својим изводима. При томе ће се електрони гомилати на цинканом суду, тј. цинкани плашт прикупља негативни извод, а угљена шипка позитивни извод или пол батерије.
Принцип рада[уреди | уреди извор]
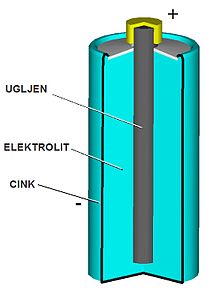
Негативни пол (анода) је цинкана чашица. Позитивни пол (катода) је угљени штапић у смеси манган-диоксида (MnO2) и угљене прашине (чађи). Електролит је водени раствор амонијум хлорида (NH4Cl(aq)) и цинк хлорида (ZnCl2) који је додавањем скроба претворен у пасту.
Затварањем струјног кола између негативног и позитивног пола (искориштавања „батерије”), почињу реакције:
- анодна реакција на негативном полу (чашици):
- Zn → Zn2+ + 2e-
- катодна реакција на позитивном полу (штапићу):
- 2MnO2 + 2e- + 2NH4+ → Mn2O3 + 2NH3 + H2O
Збрајањем те две реакције се добија:
- Zn + 2MnO2 + 2NH4+ → Zn2+ + Mn2O3 + 2NH3 + H2O
Дакле, на негативном се полу ослобађају два електрона која путују кроз потрошач (где обављају одређени рад) те долазе до позитивног пола, где учествују у хемијској реакцији. Кад се сав цинк на чашици „потроши” (односно кад већина цинка отпусти по два електрона), хемијска реакција више није могућа па се каже да је „батерија празна”. Лекланшов чланак није поново пуњив, односно након „потрошње” цинка постаје неупотребљив. Покушај пуњења батерија које нису за то предвиђене, редовно резултира експлодирањем, или у најмању руку „надувавањем” батерије с цурењем агресивог електролита који нагриза уређаје у које је батерија уложена.

Нови Лекланшов чланак (цинк-угаљ) даје напон од 1,5 V. Неке врсте батерија (литијумске, никал-кадмијумске и др.) могу међутим имати и мањи радни напон, тј. 1,2 V по чланку. За веће напоне, комбинује се (повезује се у серију) више чланака. Батерије имају мали капацитет, па се користе за уређаје с малом потрошњом струје. За већу потрошњу користе се акумулатори или исправљачи, који прикључени на градску електричну мрежу, постају једносмерни извор. Исправљачи се често уграђују у уређај који напајају.
Компоненте[уреди | уреди извор]

Ћелије у батерији могу бити повезане паралелно, серијски или комбиновано. Паралелна веза представља везу истоимених електрода и даје исти напон као једна ћелија, али јачу струју због смањене унутрашње отпорности извора. Серијска веза представља везу где се катода једне везује на аноду друге ћелије што на крају даје исту струју као једна ћелија али већи напон. Највећи број батерија које се користе у пракси има серијску везу.
Врсте[уреди | уреди извор]
Постоји више врста батерија:
- Ni-Cd (никал-кадмијум) батерија. Она представља прву широко прихваћену пуњиву батерију опште намене. Иако јој је хемијски састав еколошки неприхваћен, велики животни век чини је и данас врло погодном за одређене примене.
- Ni-MH (никал метални хидрид) батерије су врло раширен тип батерија за мобилне телефоне. Одликује их 30% већи капацитет од NiCd батерија.
- Li-јон (литијумски јон) батерије су савремени тип батерије које данас преовладавају као извор напајања мобилних телефона. Одликује их мала маса, знатно већи капацитет од NiMH батерија и већи напон, али су саме по себи врло осетљиве.
- Литијум-полимер је нова генерација батерија са својствома врло сличним Li-јонским батријама.
- Цинк-ваздух су батерије нове технологије.
Упозорење[уреди | уреди извор]
На комерцијалним батеријама најчешће пише да се не могу (не смеју) пунити, јер може доћи до њиховог претераног загревања, па чак и експлозије. Пошто се у батеријама налазе хемијска једињења опасна по људски организам и животну средину потребно је обратити пажњу при руковању са њима.
- Треба водити рачуна да нарочито мала деца не дођу у контакт са батеријама, јер је опасно да их прогутају (може доћи до тровања).
- После употребе (празне) батерије не треба бацати на сметлиште или у природу већ их треба прикупљати и рециклирати, како се не би загађивала вода и земљиште (животна средина).
Референце[уреди | уреди извор]
- ^ Crompton, T.R. (2000). Battery Reference Book (third изд.). Newnes. стр. Glossary 3. ISBN 978-0-08-049995-6. Приступљено 18. 3. 2016.
- ^ Pauling, Linus (1988). „15: Oxidation-Reduction Reactions; Electrolysis.”. General Chemistry. New York: Dover Publications, Inc. стр. 539. ISBN 978-0-486-65622-9.
- ^ Dell, Ronald M.; Rand, David A. J. (ур.), Energy storage in batteries, Royal Society of Chemistry, стр. 1—8, ISBN 978-0-85404-605-8, Приступљено 2020-10-19
- ^ Pistoia, Gianfranco (2005). Batteries for Portable Devices. Elsevier. стр. 1. ISBN 978-0-08-045556-3. Приступљено 18. 3. 2016.
- ^ Power Shift: DFJ on the lookout for more power source investments Архивирано 2005-12-01 на сајту Wayback Machine.Draper Fisher Jurvetson. Приступљено 20 November 2005.
- ^ Bellis, Mary. History of the Electric Battery Архивирано на сајту Wayback Machine (7. март 2023). About.com. Приступљено 11 August 2008.
- ^ Society, National Geographic. „Quiz: What You Don't Know About Batteries”. National Geographic.
- ^ Bellis, Mary. Biography of Alessandro Volta – Stored Electricity and the First Battery Архивирано на сајту Wayback Machine (18. фебруар 2020). About.com. Приступљено 7 August 2008.
- ^ Stinner, Arthur. Alessandro Volta and Luigi Galvani Архивирано 2008-09-10 на сајту Wayback Machine (PDF). Приступљено 11 August 2008.
- ^ Electric Battery History – Invention of the Electric Battery Архивирано на сајту Wayback Machine (22. фебруар 2019). The Great Idea Finder. Приступљено 11 August 2008.
- ^ Battery History, Technology, Applications and Development. MPower Solutions Ltd. Приступљено 19 March 2007.
- ^ Borvon, Gérard (10. 9. 2012). „History of the electrical units”. Association S-EAU-S.
- ^ „Columbia Dry Cell Battery”. National Historic Chemical Landmarks. American Chemical Society. Архивирано из оригинала 23. 2. 2013. г. Приступљено 25. 3. 2013.
- ^ Leclanché, "une pile à oxyde insoluble" [an insoluble oxide battery], French patent no. 71,865 (issued: 8 June 1866) in: French Ministry of Agriculture and Commerce (1881). Description des machines et procédés pour lesquels des brevets d'invention ont été pris … [Descriptions of machines and procedures for which patents have been taken …] (на језику: French). vol. 98. Paris, France: Imprimerie Nationale. стр. 33—34.
- ^ Leclanché, Georges (1868). „Quelques observations sur l’emploi des piles électriques. Pile constante au peroxyde de manganèse à un seul liquide.”. Les mondes. 16: 532.
- ^ Jensen, William B. (јануар 2014). „The Leclanché Cell. Museum Notes, Oesper Collections.”. Приступљено 26. 12. 2017.
Литература[уреди | уреди извор]
- Pistoia, Gianfranco (2005). Batteries for Portable Devices. Elsevier. стр. 1. ISBN 978-0-08-045556-3. Приступљено 18. 3. 2016.
- Pauling, Linus (1988). „15: Oxidation-Reduction Reactions; Electrolysis.”. General Chemistry. New York: Dover Publications, Inc. стр. 539. ISBN 978-0-486-65622-9.
- Crompton, T.R. (2000). Battery Reference Book (third изд.). Newnes. стр. Glossary 3. ISBN 978-0-08-049995-6. Приступљено 18. 3. 2016.
- Dingrando, Laurel; et al. (2007). Chemistry: Matter and Change. New York: Glencoe/McGraw-Hill. ISBN 978-0-07-877237-5. Ch. 21 (pp. 662–695) is on electrochemistry.
- Fink, Donald G.; Beaty, H. Wayne (1978). Standard Handbook for Electrical Engineers, Eleventh Edition. New York: McGraw-Hill. ISBN 978-0-07-020974-9.
- Knight, Randall D. (2004). Physics for Scientists and Engineers: A Strategic Approach. San Francisco: Pearson Education. ISBN 978-0-8053-8960-9. Chs. 28–31 (pp. 879–995) contain information on electric potential.
- Linden, David; Reddy, Thomas B. (2001). Handbook of Batteries. New York: McGraw-Hill. ISBN 978-0-07-135978-8.
- Saslow, Wayne M. (2002). Electricity, Magnetism, and Light. Toronto: Thomson Learning. ISBN 978-0-12-619455-5. Chs. 8–9 (pp. 336–418) have more information on batteries.
Спољашње везе[уреди | уреди извор]
- Професионалци: Дејан Илић, научник, РТС Приказује - Званични канал
- Брзи водич кроз батерије за градитеље робота (језик: енглески)
- Електрохемијска енциклопедија - Једнократне батерије (језик: енглески)
- Речник и терминологија батерија (језик: енглески)
- Технологије батерија - Именик страница које покривају теорију, истраживање, развој и тржиште уређаја који побољшавају тренд у правцу чистих обновљивих извора енергије. (FreeEnergyNews) (језик: енглески)
- Свет преносивих батерија - Приручник о пуњивим батеријама за лаике - садржи обимну секцију питања и одговора о пуњивим батеријама (језик: енглески)
- Развој батерија - Историја батерија, енергије и сродних технологија (језик: енглески)
- Гориве ћелије за мобилне телефоне долазе у 2007. Infoworld July 13, 2005 (језик: енглески)
- Ресурси батерија на PESWiki, отвореном вики порталу о алтернативним и обновљивим енергетским решењима (језик: енглески)
- Таблице за прорачуне вредности (језик: енглески)
- Практична знања о батеријама (језик: енглески)


