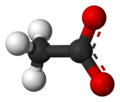
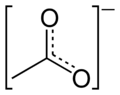
Ацетат
Ацетат је со сирћетне киселине.[1] Сирћетна киселина (СН3СООН) је супстанца растворна у води, која ступа у реакције са многим једињењим.
Ацетати се у раствору другачије понашају у односу на киселину од које потичу. Они у великом броју случајева посредством хидролизе, а утицајем јачег металног јона, попримају базне особине. Једињења су нестабилна и дешава се да, током времена, одређена количина ацетата пређе у други облик, а то прати ослобађање киселине, чији се мирис осећа при отварању посуде у којој се та супстанца налази. У структурном погледу, киселина спада у монокарбоксилне киселине и на карбоксилну групу је везана само једна метил група, која има значајан утицај на реактивност читавог молекула. Електронегативнији кисеоник има индуктивни ефекатпривлачења електрона са суседног угљеника карбоксилне групе. Самим тим, богати се електронима кисеоник, а осиромашује угљеник, који ипак мора то да надокнади привлачењем електрона, али знатно слабијим, са суседне метил групе. Структура ацетатног јона је такође значајна за реактивност молекула који га садржи. Комбинација различитих типова хибридизације одиграва значајну улогу. Метил група је sp3 хибридизована, а хибридизација карбоксилне групе је sp2. Оваква комбинација омогућава катактеристичну просторну оријентацију и различитост у угловима веза, што поједине атоме јона штити, а друге наводи на реакцију.
Сама сирћетна киселина спада у слабе киселине, па најлакше реагује са јаким базама као што су NaOH (натријум хидроксид, жива сода) и KOH (калијум хидроксид), градећи одговарајућу со (натријум или калијум ацетат), при чему се издваја вода.[1] При овој реакцији нису потребни катализатори јер се реакција лако одвија.[2]
CH3–CH2COOH + NaOH → CH3-CH2COONa + H2O
Вода настаје реакцијом H+ јона из COOH групе и ОН- групе из натријум хидроксида. Натријум ацетат се издваја при овој реакцији као бео талог на дну епрувете. Сирћетна киселина са неком од својих соли са алкалним металима гради врло стабилне пуфере који се користе ради постизања одречене pH вредности. Ацетати као соли јаких база и сирћетне киселине реагују базно у процесу хидролизе.[1] Постоје случајеви када ацетати не реагују базно, већ неутрално и то приближно код СН3COONH4, где су оба јона слаба и имају сличне производе растворљивости у води. Ацетати нису соли сирћетне киселине само са неорганским базама. Постоје и органска једињења која су само због своје органске природе названа естри, а која настају реакцијом естерификације у којој учествује киселина и алкохол, у присуству најчешће концентроване сумпорне киселине. Долази до стварања естара карактеристичних особина. Постоји неклико огледа који показују природу ацетата.[1] Одмери се приближно иста количина натријум-ацетата и воде и то се помеша, загрева до кључања, а потом хлади нагло под млазом хладне воде. У тако охлађеном раствору при додавању неколико кристала исте соли, долази до бурне и јасно видљиве кристализације.[3][4] Гради и токсична једињења, а познат је оловни шећер.
Структуре
[уреди | уреди извор]-
простор-попуњавајући модел ацетатног анјона -
кугла-и-штап модел ацетатног анјона -
резонантни хибрид ацетатног анјона -
канонички облици ацетатног анјона
Референце
[уреди | уреди извор]- ^ а б в г McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd изд.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ^ Zumdahl 1986
- ^ Lide David R., ур. (2006). CRC Handbook of Chemistry and Physics (87th изд.). Boca Raton, FL: CRC Press. ISBN 978-0-8493-0487-3.
- ^ Susan Budavari, ур. (2001). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (13th изд.). Merck Publishing. ISBN 0911910131.
Литература
[уреди | уреди извор]- Zumdahl, Steven S. (1986). Chemistry. Lexington, Mass: D.C. Heath. ISBN 978-0-669-04529-1.