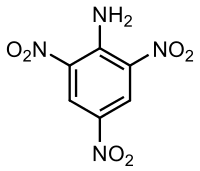
2,4,6-Тринитроанилин
| |

| |
| Идентификација | |
|---|---|
3Д модел (Jmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.007.004 |
| |
| Својства | |
| C6H4N4O6 | |
| Моларна маса | 228,119 |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25 °C [77 °F], 100 kPa). | |
| Референце инфокутије | |
2,4,6-Тринитроанилин, скраћено (ТНА) са хемијском формулом C6Х4Н4О6 и такође познат као пирамид, је органско једињење, које садржи 6 атома угљеника и има молекулску масу од 228,119 Da.
Материјали у овој групи се крећу од благих до јаких оксидационих средстава. Ако се помешају са редукционим агенсима, укључујући хидриде, сулфиде и нитриде, могу започети снажну реакцију која кулминира детонацијом. Ароматична нитро једињења могу експлодирати у присуству базе као што је натријум-хидроксид или калијум-хидроксид чак и у присуству воде или органских растварача. Експлозивне тенденције ароматичних нитро једињења су повећане присуством више нитро група.[3] Изглед тринитроанилина варира од жуте преко наранџасте до црвене у зависности од његове чистоће и концентрације.
Прављење[уреди | уреди извор]
Препарат се прави од тринитрохлоробензена реакцијом са амонијаком или нитрацијом п-нитроанилина.[4][5]
Апликације/Употребе[уреди | уреди извор]
Тринитроанилин се данас користи само у малим бојевим главама неких експлозивних направа као што су минобацачи. У Другом светском рату користила га је јапанска царска морнарица као Тип 97 бакујаку (модел 1931 експлозив) у неким верзијама топовских пројектила уместо мање стабилне пикринске киселине.[6] Такође је коришћен у Јокосука МXY-7 Ока, камиказа ракетном авиону вођеном људском посадом намењеном за нападе на војне ратне бродове.
Особине[уреди | уреди извор]
| Особина | Вредност |
|---|---|
| Број акцептора водоника | 7 |
| Број донора водоника | 1 |
| Број ротационих веза | 3 |
| Партициони коефицијент[7] (ALogP) | 0,8 |
| Растворљивост[8] (logS, log(mol/L)) | -3,9 |
| Поларна површина[9] (PSA, Å2) | 163,5 |
Карактеристике[уреди | уреди извор]
Тринитроанилин је кристална чврста супстанца. Једињење је посебно експлозивно када је суво услед удара, трења, топлоте и других извора паљења[10] и подлеже Закону о експлозивима приликом руковања са њим.[11]
Табела са важним својствима везаним за експлозију: Баланс кисеоника −56,1 %[4] Садржај азота 24,56 %[4] Нормална запремина гаса 972 л·кг−1[4] Експлозивна топлота 3592 кЈ·кг−1 (Х2О (л))
3498 кЈ·кг−1 (Х2О (г))[4]Специфична енергија 972 кЈ·кг−1 (68,1 мт/кг)[4] Тест оловног блока 31,0 цм³·г−1[4] Брзина детонације 7300 м·с−1[4] Тачка дефлаграције 346 °Ц (655 °Ф; 619 К)[4] Тест челичне чауре Гранични пречник 3,5 мм[4] Осетљивост на удар 15 Нм[4] Осетљивост на трење до 353 Н пин оптерећење без реакције[4]
Здравље и безбедност[уреди | уреди извор]
Тринитроанилин је опасно експлозиван. Симптоми изложености овом једињењу могу укључивати иритацију коже и очију, главобољу, поспаност, слабост, цијанозу и респираторну узнемиреност.
Види још[уреди | уреди извор]
- Анилин
- Пикринска киселина
- Тетрил
- Хемија
- Органска хемија
- Номенклатура Међународне уније за чисту и примењену хемију
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ „2,4,6-TRINITROANILINE | CAMEO Chemicals | NOAA”.
- ^ а б в г д ђ е ж з и ј к Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage, Wiley-VCH, Weinheim 2008, S. 328, ISBN 978-3-527-32009-7
- ^ Explosivstoffe, Wasag-Chemie, Essen 1961, S. 163.
- ^ „Definitions and Information about Naval Guns - NavWeaps”.
- ^ Ghose, A.K.; Viswanadhan V.N. & Wendoloski, J.J. (1998). „Prediction of Hydrophobic (Lipophilic) Properties of Small Organic Molecules Using Fragment Methods: An Analysis of AlogP and CLogP Methods”. J. Phys. Chem. A. 102: 3762—3772. doi:10.1021/jp980230o.
- ^ Tetko IV, Tanchuk VY, Kasheva TN, Villa AE (2001). „Estimation of Aqueous Solubility of Chemical Compounds Using E-State Indices”. Chem Inf. Comput. Sci. 41: 1488—1493. PMID 11749573. doi:10.1021/ci000392t.
- ^ Ertl P.; Rohde B.; Selzer P. (2000). „Fast calculation of molecular polar surface area as a sum of fragment based contributions and its application to the prediction of drug transport properties”. J. Med. Chem. 43: 3714—3717. PMID 11020286. doi:10.1021/jm000942e.
- ^ Ротх, L.; Wеллер, У.: Гефäхрлицхе Цхемисцхе Реактионен, 65. Ергäнзунгслиеферунг, ецомед-Верлаг 2011.
- ^ Спренгстоффгесетз, Анханг I, Листе дер еxплосионсгефäхрлицхен Стоффе ауф дие дас Гесетз ин воллем Умфанг анзуwенден ист.
Литература[уреди | уреди извор]
- Цлаyден, Јонатхан; Греевес, Ницк; Wаррен, Стуарт; Wотхерс, Петер (2001). Органиц Цхемистрy (I изд.). Оxфорд Университy Пресс. ИСБН 978-0-19-850346-0.
- Смитх, Мицхаел Б.; Марцх, Јеррy (2007). Адванцед Органиц Цхемистрy: Реацтионс, Мецханисмс, анд Струцтуре (6тх изд.). Неw Yорк: Wилеy-Интерсциенце. ИСБН 0-471-72091-7.
- Катритзкy А.Р.; Позхарскии А.Ф. (2000). Хандбоок оф Хетероцyцлиц Цхемистрy (Сецонд изд.). Ацадемиц Пресс. ИСБН 0080429882.
Додатна литература[уреди | уреди извор]
- Холден, Јамес Р.; Дицкинсон, Цхарлес; Боцк, Цхарлес M. (1972). „Црyстал струцтуре оф 2,4,6-тринитроанилине”. Тхе Јоурнал оф Пхyсицал Цхемистрy. 76 (24): 3597—3602. дои:10.1021/ј100668а017.
