Цијанурични триазид

| |

| |
| Називи | |
|---|---|
| IUPAC назив
2,4,6-Триазид-1,3,5-триазин
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| УНИИ | |
| |
| |
| Својства | |
| C3N12 | |
| Моларна маса | 204,12 г·мол−1 |
| Агрегатно стање | бели кристал |
| Густина | 1,73 g·cm−3 [3] |
| Тачка топљења | 94 °Ц (201 °Ф; 367 К) |
| Тачка кључања | 150 °Ц (302 °Ф; 423 К) Распадање или експлозија |
| Опасности | |
| Главне опасности | Експлозивна супстанца |
| Тачка паљења | [4] |
| 205 °Ц (401 °Ф; 478 К) | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°Ц [77°Ф], 100 кПа). | |
| Референце инфокутије | |
Цијанурски триазид или (2,4,6-Триазид-1,3,5-триазин) (C3Н12 или (НЦН3)3) је описан као еколошки прихватљив, ниске токсичности и органски примарни експлозив са брзином детонације од око 7.300 м/с−1, и температуром паљења на 205 °Ц (401 °Ф; 478 К).
Историја[уреди | уреди извор]
Прва наводна производња већ је описана 1907. године од стране Фингера. [5] Међутим, ова производња није могла бити потврђена. Прва сигурна производња је био препарат од цијануринског хлорида и натријум азида који је описао От [6] 1921. године, који је такође заштићен у неколико патената. [7] [8] [9]
Припрема[уреди | уреди извор]
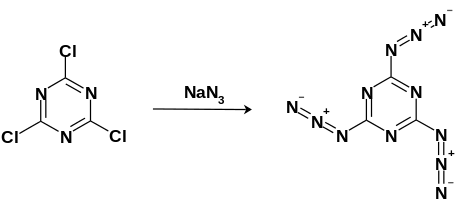
Цијанурични триазид се добија нуклеофилном ароматичном супституцијом коришћењем цијануричног трихлорида (2,4,6-Трихлоро-1,3,5-триазин) са вишком натријум азида. Реакција се одвија у ацетону при кључању. Добијени производ се може пречистити рекристализацијом у толуену.
Структура[уреди | уреди извор]
Молекул цијануричног триазида је раван и има троструку осну симетрију – трискелион са молекулском тачкастом групом C3х. [10][11] 1,3,5-Триазински (или цијанурички) прстен се састоји од наизменичних атома угљеника и азота са дужинама Ц–Н везе од 1,334 до 1,336 А. Удаљеност од центра прстена до сваког атома угљеника у прстену је 1,286 А, док је одговарајућа удаљеност до азота у прстену 1,379 А. Азидне групе су повезане са атомима угљеника на цијануричном прстену једноструким везама са међуатомским растојањем од 1,399 А. [12]
Појава[уреди | уреди извор]
Ово једињење је чисто синтетичко и стога не постоји у природи.
Синтеза[уреди | уреди извор]
Цијанурични триазид се може синтетизовати путем нуклеофилне ароматичне супституције мешањем цијанур-трихлорида са вишком натријум азида у кључајућем ацетону. Бели кристали се затим могу пречистити кристализацијом у толуену на −20 °Ц (−4 °Ф; 253 К). [13]
Реакције разлагања[уреди | уреди извор]
Утврђено је да је ова бела поликристална чврста супстанца стабилна у стандардним условима, али је изузетно осетљива на ударце због чега се насилно распада када се меље у авану. Термодинамичка својства цијануричног триазида су проучавана коришћењем калориметрије бомбе са енталпијом сагоревања (Х) од 2.234 кЈ мол-1 у условима оксидације и 740 кЈ мол-1 у другим условима. Прва вредност је упоредива са војним експлозивом РДX, (C3Н3)(НО3)3Х6, али се не користи због своје мање повољне стабилности. Испитивање тачке топљења је показало оштар опсег топљења до бистре течности на 94—95 °Ц (201—203 °Ф; 367—368 К), развијање (еволуцију) гаса на 155 °Ц (311 °Ф; 428 К), промену боје раствора од наранџасте до браон на 170 °Ц (338 °Ф; 443 К), наранџасто-браон очвршћава на 200 °Ц (392 °Ф; 473 К) и има брзо распадање на 240 °Ц (464 °Ф; 513 К), а то брзо распадање на 240 °Ц (464 °Ф; 513 К) је резултат формирања елементарног угљеника у облику графита и формирања гаса азота. [13]
Карактеристике[уреди | уреди извор]
'Цијанурични триазид формира безбојне кристале у облику игле [6] који се топе на 94 °Ц (201 °Ф; 367 К) са енталпијом фузије од 22,2 кЈ мол-1. [14] [15] Функција притиска сублимације је резултат према Августу према лн(П) = −А/Т+Б (П у Па, Т у К) са А = 10018,76 и Б = 14,0. [15] Топлота сублимације је 83,3 кЈ мол−1. [15] Прве анализе кристалне структуре претпостављале су хексагоналну симетрију. [16][17] Према новијим сазнањима, једињење кристалише у тригоналном кристалном систему са просторном групом П-3 (просторна група бр. 147) и са два молекула у јединичној ћелији. [18]
Када се загреје, једињење има тенденцију да се експлозивно распадне изнад 170—180 °Ц (338—356 °Ф; 443—453 К). [14][19] Веза је осетљива на ударце и трење. [19]
Када се рукује овим једињењем, оно потпада под Закон о експлозивима. [20] Важни подаци експлозивности су:
Табела са важним својствима везаним за експлозију: Баланс кисеоника −47 % [21] Садржај азота 82,36 % [21] Избочење оловног блока 41,5 цм3·г−1 [21] Брзина детонације 5500 м·с−1 [21] Тачка дефлаграције 200—205 °Ц (392—401 °Ф; 473—478 К) [21]
Референце[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Haynes, W. M.; Lide, D. R. (2012). CRC Handbook of Chemistry and Physics 93rd Ed. CRC Press/Taylor and Francis. ISBN 978-1439880494.
- ^ Mikhail A. Ilyushin, Igor V. Tselinsky And Irina V. Shugalei (2012). „Environmentally Friendly Energetic Materials for Initiation Devices” (PDF). Central European Journal of Energetic Materials. 9 (4): 293—327.
- ^ Finger, H. (1907). „Über Abkömmlinge des Cyanurs. (Vorläufige Mitteilung)”. Journal für Praktische Chemie. 75: 103—104. doi:10.1002/prac.19070750107.
- ^ а б Ott, Erwin; Ohse, Ernst (1921). „Zur Kenntnis einfacher Cyan- und Cyanurverbindungen. II. Über das Cyanurtriazid, (C 3 N 12 )”. Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 54 (2): 179—186. doi:10.1002/cber.19210540202.
- ^ E. Ott, DE 346 811.
- ^ E. Ott, DE 346 812.
- ^ E. Ott, DE 343 794.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. стр. 1291. ISBN 0080379419.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. стр. 94—99. ISBN 978-0-13-175553-6.
- ^ Keßenich, Elmar; Klapötke, Thomas M.; Knizek, Jörg; Nöth, Heinrich; Schulz, Axel (1998). „Characterization, Crystal Structure of 2,4-Bis(triphenylphosphanimino)tetrazolo[5,1-a]-[1,3,5]triazine, and Improved Crystal Structure of 2,4,6-Triazido-1,3,5-triazine”. Eur. J. Inorg. Chem. 1998 (12): 2013—2016. doi:10.1002/(SICI)1099-0682(199812)1998:12<2013::AID-EJIC2013>3.0.CO;2-M.
- ^ а б Gillan, Edward G. (2000). „Synthesis of Nitrogen-Rich Carbon Nitride Networks from an Energetic Molecular Azide Precursor”. Chemistry of Materials. 12 (12): 3906—3912. doi:10.1021/cm000570y.
- ^ а б Ye, Chengfeng; Gao, Haixiang; Boatz, Jerry A.; Drake, Gregory W.; Twamley, Brendan; Shreeve, Jean'ne M. (2006). „Polyazidopyrimidines: High-Energy Compounds and Precursors to Carbon Nanotubes”. Angewandte Chemie. 118 (43): 7420—7423. doi:10.1002/ange.200602778.
- ^ а б в Korsunskiy, Boris L.; Nedel'Ko, Vadim V.; Zakharov, Viktor V.; Chukanov, Nikita V.; Chervonnyi, Alexandr D.; Larikova, Tatiana S.; Chapyshev, Sergey V. (2017). „Thermochemistry of Evaporation and Sublimation of 2,4,6-Triazido-1,3,5-triazine”. Propellants, Explosives, Pyrotechnics. 42 (2): 123—125. doi:10.1002/prep.201600259.
- ^ Knaggs, I. Ellie (1935). „Crystal Structure of Cyanuric Triazide”. Nature. 135 (3407): 268. doi:10.1038/135268a0.
- ^ Hughes, Edward W. (1935). „The Crystal Structure of Cyanuric Triazide”. The Journal of Chemical Physics. 3: 1—5. doi:10.1063/1.1749546.
- ^ E. Keßenich, T. M. Klapötke, J. Knizek, H. Nöth, A. Schulz (1998), „Characterization, Crystal Structure of 2,4-Bis(triphenylphosphanimino)tetrazolo[5,1-a]-[1,3,5]triazine, and Improved Crystal Structure of 2,4,6-Triazido-1,3,5-triazine”, European Journal of Inorganic Chemistry (на језику: немачки) (12), pp. 2013–2016, doi:10.1002/(SICI)1099-0682(199812)1998:12<2013::AID-EJIC2013>3.0.CO;2-M
- ^ а б P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 306.
- ^ Sprengstoffgesetz, Anhang I, Liste der explosionsgefährlichen Stoffe, auf die das Gesetz in vollem Umfang anzuwenden ist.
- ^ а б в г д J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7, S. 67.