Cijanurični triazid

| |

| |
| Називи | |
|---|---|
| IUPAC назив
2,4,6-Triazid-1,3,5-triazin
| |
| Идентификација | |
3Д модел (Jmol)
|
|
| ChemSpider | |
| UNII | |
| |
| |
| Својства | |
| C3N12 | |
| Моларна маса | 204,12 g·mol−1 |
| Агрегатно стање | beli kristal |
| Густина | 1,73 g·cm−3 [3] |
| Тачка топљења | 94 °C (201 °F; 367 K) |
| Тачка кључања | 150 °C (302 °F; 423 K) Raspadanje ili eksplozija |
| Опасности | |
| Главне опасности | Eksplozivna supstanca |
| Тачка паљења | [4] |
| 205 °C (401 °F; 478 K) | |
Уколико није другачије напоменуто, подаци се односе на стандардно стање материјала (на 25°C [77°F], 100 kPa). | |
| Референце инфокутије | |
Cijanurski triazid ili (2,4,6-Triazid-1,3,5-triazin) (C3N12 ili (NCN3)3) je opisan kao ekološki prihvatljiv, niske toksičnosti i organski primarni eksploziv sa brzinom detonacije od oko 7.300 m/s−1, i temperaturom paljenja na 205 °C (401 °F; 478 K).
Istorija[уреди | уреди извор]
Prva navodna proizvodnja već je opisana 1907. godine od strane Fingera. [5] Međutim, ova proizvodnja nije mogla biti potvrđena. Prva sigurna proizvodnja je bio preparat od cijanurinskog hlorida i natrijum azida koji je opisao Ot [6] 1921. godine, koji je takođe zaštićen u nekoliko patenata. [7] [8] [9]
Priprema[уреди | уреди извор]
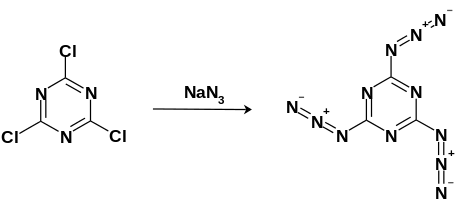
Cijanurični triazid se dobija nukleofilnom aromatičnom supstitucijom korišćenjem cijanuričnog trihlorida (2,4,6-Trihloro-1,3,5-triazin) sa viškom natrijum azida. Reakcija se odvija u acetonu pri ključanju. Dobijeni proizvod se može prečistiti rekristalizacijom u toluenu.
Struktura[уреди | уреди извор]
Molekul cijanuričnog triazida je ravan i ima trostruku osnu simetriju – triskelion sa molekulskom tačkastom grupom C3h. [10][11] 1,3,5-Triazinski (ili cijanurički) prsten se sastoji od naizmeničnih atoma ugljenika i azota sa dužinama C–N veze od 1,334 do 1,336 A. Udaljenost od centra prstena do svakog atoma ugljenika u prstenu je 1,286 A, dok je odgovarajuća udaljenost do azota u prstenu 1,379 A. Azidne grupe su povezane sa atomima ugljenika na cijanuričnom prstenu jednostrukim vezama sa međuatomskim rastojanjem od 1,399 A. [12]
Pojava[уреди | уреди извор]
Ovo jedinjenje je čisto sintetičko i stoga ne postoji u prirodi.
Sinteza[уреди | уреди извор]
Cijanurični triazid se može sintetizovati putem nukleofilne aromatične supstitucije mešanjem cijanur-trihlorida sa viškom natrijum azida u ključajućem acetonu. Beli kristali se zatim mogu prečistiti kristalizacijom u toluenu na −20 °C (−4 °F; 253 K). [13]
Reakcije razlaganja[уреди | уреди извор]
Utvrđeno je da je ova bela polikristalna čvrsta supstanca stabilna u standardnim uslovima, ali je izuzetno osetljiva na udarce zbog čega se nasilno raspada kada se melje u avanu. Termodinamička svojstva cijanuričnog triazida su proučavana korišćenjem kalorimetrije bombe sa entalpijom sagorevanja (H) od 2.234 kJ mol-1 u uslovima oksidacije i 740 kJ mol-1 u drugim uslovima. Prva vrednost je uporediva sa vojnim eksplozivom RDX, (C3N3)(NO3)3H6, ali se ne koristi zbog svoje manje povoljne stabilnosti. Ispitivanje tačke topljenja je pokazalo oštar opseg topljenja do bistre tečnosti na 94—95 °C (201—203 °F; 367—368 K), razvijanje (evoluciju) gasa na 155 °C (311 °F; 428 K), promenu boje rastvora od narandžaste do braon na 170 °C (338 °F; 443 K), narandžasto-braon očvršćava na 200 °C (392 °F; 473 K) i ima brzo raspadanje na 240 °C (464 °F; 513 K), a to brzo raspadanje na 240 °C (464 °F; 513 K) je rezultat formiranja elementarnog ugljenika u obliku grafita i formiranja gasa azota. [13]
Karakteristike[уреди | уреди извор]
Cijanurični triazid formira bezbojne kristale u obliku igle [6] koji se tope na 94 °C (201 °F; 367 K) sa entalpijom fuzije od 22,2 kJ mol-1. [14] [15] Funkcija pritiska sublimacije je rezultat prema Avgustu prema ln(P) = −A/T+B (P u Pa, T u K) sa A = 10018,76 i B = 14,0. [15] Toplota sublimacije je 83,3 kJ mol−1. [15] Prve analize kristalne strukture pretpostavljale su heksagonalnu simetriju. [16][17] Prema novijim saznanjima, jedinjenje kristališe u trigonalnom kristalnom sistemu sa prostornom grupom P-3 (prostorna grupa br. 147) i sa dva molekula u jediničnoj ćeliji. [18]
Kada se zagreje, jedinjenje ima tendenciju da se eksplozivno raspadne iznad 170—180 °C (338—356 °F; 443—453 K). [14][19] Veza je osetljiva na udarce i trenje. [19]
Kada se rukuje ovim jedinjenjem, ono potpada pod Zakon o eksplozivima. [20] Važni podaci eksplozivnosti su:
Tabela sa važnim svojstvima vezanim za eksploziju: Balans kiseonika −47 % [21] Sadržaj azota 82,36 % [21] Izbočenje olovnog bloka 41,5 cm3·g−1 [21] Brzina detonacije 5500 m·s−1 [21] Tačka deflagracije 200—205 °C (392—401 °F; 473—478 K) [21]
Reference[уреди | уреди извор]
- ^ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today. 15 (23-24): 1052—7. PMID 20970519. doi:10.1016/j.drudis.2010.10.003.
- ^ Evan E. Bolton; Yanli Wang; Paul A. Thiessen; Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry. 4: 217—241. doi:10.1016/S1574-1400(08)00012-1.
- ^ Haynes, W. M.; Lide, D. R. (2012). CRC Handbook of Chemistry and Physics 93rd Ed. CRC Press/Taylor and Francis. ISBN 978-1439880494.
- ^ Mikhail A. Ilyushin, Igor V. Tselinsky And Irina V. Shugalei (2012). „Environmentally Friendly Energetic Materials for Initiation Devices” (PDF). Central European Journal of Energetic Materials. 9 (4): 293—327.
- ^ H. Finger: Über Abkömmlinge des Cyanurs. (Vorläufige Mitteilung). In: J. prakt. Chem. 75, 1907, S. 103–104, doi:10.1002/prac.19070750107.
- ^ а б E. Ott, E. Ohse: Zur Kenntnis einfacher Cyan- und Cyanurverbindungen. II. Über das Cyanurtriazid (C3N12). In: Chem. Ber. 54, 1921, S. 179–186, doi:10.1002/cber.19210540202.
- ^ E. Ott, DE 346 811.
- ^ E. Ott, DE 346 812.
- ^ E. Ott, DE 343 794.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. стр. 1291. ISBN 0080379419.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. стр. 94—99. ISBN 978-0-13-175553-6.
- ^ Keßenich, Elmar; Klapötke, Thomas M.; Knizek, Jörg; Nöth, Heinrich; Schulz, Axel (1998). „Characterization, Crystal Structure of 2,4-Bis(triphenylphosphanimino)tetrazolo[5,1-a]-[1,3,5]triazine, and Improved Crystal Structure of 2,4,6-Triazido-1,3,5-triazine”. Eur. J. Inorg. Chem. 1998 (12): 2013—2016. doi:10.1002/(SICI)1099-0682(199812)1998:12<2013::AID-EJIC2013>3.0.CO;2-M.
- ^ а б Gillan, Edward G. (2000). „Synthesis of Nitrogen-Rich Carbon Nitride Networks from an Energetic Molecular Azide Precursor”. Chemistry of Materials. 12 (12): 3906—3912. doi:10.1021/cm000570y.
- ^ а б C. Ye, H. Gao, J. A. Boatz, G. W. Drake, B. Twamley, J. M. Shreeve: Polyazidopyrimidines: High-Energy Compounds and Precursors to Carbon Nanotubes. In: Angew. Chem. 118, 2006, S. 7420–7423, doi:10.1002/ange.200602778.
- ^ а б в B. L. Korsunskiy, V. V. Nedel'ko, V. V. Zakharov, N. V. Chukanov, A. D. Chervonnyi, T. S. Larikova, S. V. Chapyshev: Thermochemistry of Evaporation and Sublimation of 2,4,6-Triazido-1,3,5-triazine. In: Propellants, Explosives, Pyrotechnics. Vol 42, Nr. 2, 2017, S. 123–125, doi:10.1002/prep.201600259.
- ^ I. E. Knaggs: Crystal Structure of Cyanuric Triazide. In: Nature. 135, 1935, S. 268–268, doi:10.1038/135268a0.
- ^ E. W. Hughes: The Crystal Structure of Cyanuric Triazide. In: J. Chem. Phys. 3, 1935, S. 1–5, doi:10.1063/1.1749546.
- ^ E. Keßenich, T. M. Klapötke, J. Knizek, H. Nöth, A. Schulz (1998), „Characterization, Crystal Structure of 2,4-Bis(triphenylphosphanimino)tetrazolo[5,1-a]-[1,3,5]triazine, and Improved Crystal Structure of 2,4,6-Triazido-1,3,5-triazine”, European Journal of Inorganic Chemistry (на језику: немачки) (12), pp. 2013–2016, doi:10.1002/(SICI)1099-0682(199812)1998:12<2013::AID-EJIC2013>3.0.CO;2-M
- ^ а б P.G. Urben; M.J. Pitt: Bretherick's Handbook of Reactive Chemical Hazards. 8. Edition, Vol. 1, Butterworth/Heinemann 2017, ISBN 978-0-08-100971-0, S. 306.
- ^ Sprengstoffgesetz, Anhang I, Liste der explosionsgefährlichen Stoffe, auf die das Gesetz in vollem Umfang anzuwenden ist.
- ^ а б в г д J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. 10., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7, S. 67.