Динеин

Динеин, молекулски мотор или моторни молекул је моторни протеин и велики молекул од приближно 2.000 кДа, који се састоји од два или три тешка полипептидна ланца који су у комплексу са различитим бројем лаких и интермедијарних полипептида. Налази се у ћелијама које претварају хемијску енергију аденозин трифосфата (АТП) у механичку енергију кретања. Наиме тешки ланци, формирају глобуларни, АТП-везујући, моторни домен, који је одговоран за кретање дуж микротубула, док базално тело динеина, које се састоји од лаких и интермедијарних ланаца, служи за везивање везикула и органела.[1]
Динеински транспорти разних ћелијских терета, обавља се дуж цитоскелетних микротубула према минус крају микротубула, која је обично усмерена према центру ћелије. Због ове функције, они се називају „мотори са усмерени минус крајем". Овај облик транспорта је познат као ретроградни транспорт. Насупрот томе, кинезини, који су такође моторни протеини, крећу се према плус крају микротубула и називају се „плус крајем усмерени мотори”.
Микротубуларни моторни протеини — су молекули који се састоји два тешка и два лака ланца, укупне молекулске масе од 380 кДа. Тешки ланци садрже дугачке спиралне α-хеликсе који се обмотавају један око другог и формирају структуру завојнице. Амино-терминални глобуларни домени (главе кинезина) тешких ланаца су моторни домени молекула који се везују за дублете микротубула и за АТП чија енергија омогућава кретање. Карбокси-терминални домени тешких ланаца кинезина рагују са лаким ланцима кинезина. Овај домен кинезина је одговоран и за везивање других ћелијских компоненти као што су везикуле и органеле које ће бити транспортоване дуж микротубула.[1]
Историја
[уреди | уреди извор]Први идентификовани микротубуларни моторни протеин динеин, изолован је од стране Иана Гиббонс-а, 1965. године. Двадесет година након открића динеина, 1985. године, Роналд Вале и Мицхаел Схеетз су идентификовали кинезине, моторне протеине, који се крећу према плус крају микротубула
Класификација
[уреди | уреди извор]Динеини се деле у две главне групе: цитоплазматски и аксонемски динеини, који се називају и цилијарни (трепљансти) или флагеларни (бичасти) динеини.
- Цитоплазматски динеин
- тешки ланац : ДYНЦ1Х1, ДYНЦ2Х1
- интермедијарни ланац: ДYНЦ1И1, ДYНЦ1И2
- лаки интермедијарни ланац: ДYНЦ1ЛИ1, ДYНЦ1ЛИ2, ДYНЦ2ЛИ1
- лаки ланац: ДYНЛЛ1, ДYНЛЛ2, ДYНЛРБ1, ДYНЛРБ2, ДYНЛТ1, ДYНЛТ3
- Аксонемски динеин
- тешки ланац: ДНАХ1, ДНАХ2, ДНАХ3, ДНАХ5, ДНАХ6, ДНАХ7, ДНАХ8, ДНАХ9, ДНАХ10, ДНАХ11, ДНАХ12, ДНАХ13, ДНАХ14, ДНАХ17
- интермедијарни ланац: ДНАИ1, ДНАИ2
- лаки интермедијарни ланац: ДНАЛИ1
- лаки ланац: ДНАЛ1, ДНАЛ4
Функција
[уреди | уреди извор]Кретање дуж микротубула осим присуства ИФТ комплекса А и Б, је засновано и на активности чланова две велике фамилије моторних протеина, динеина и кинезина, који користе енергију насталу хидролизом АТП-а, за стварање покрета дуж микротубула. Према томе аксонемни микротубуларног моторног протеина динеин узрокује клизање микротубула у аксонемама цилија и флагелама и налази се само у ћелијама које имају те структуре.

Цитоплазматски динеин се налази у животињским ћелијама, а постоје и биљни динеини, који помажу одвијање функција које су потребне за преживљавање ћелија, као што су транспорт органела и центрозомног апарата.[2] Цитоплазматски динеин се креће дуж микротубула, тако што су један или други својим петељкама увек везани за микротубуле, тако да динеин могу „отшетати" на значајну удаљености дуж микротубула, без скидања са њих.
Цитоплазматски динеин помаже позиционирању Голџијевог комплекса и осталих органела у ћелији.[2] Такође помаже у транспорту терета који је потребан за ћелијске функције, као што су везикуле ендоплазматског ретикулума, ендозома и лизозома. Динеин је укључен у кретање хромозома и позиционирање митотског вретена у ћелијској деоби.[3][4] Динеин носи органеле, везикуле и посебне микротубулске фрагменте дуж аксона прем,а ћелијском телу неурона у процесу ретрограднног процеса аксоплазматског транспорта.[2]
Позиционирање митотског вретена
[уреди | уреди извор]Цитоплазматски динеин позиционира вретено на месту цитокинезе помоћу сидрења на ћелијски кортекс и попуњавања на астралним микротубулима које потичу од центрозома.[5][6][7] Пупљење квасаца је снажан модел за проучавање овог процеса и показује да је динеин усмерен ка плус крајевима астралних микротубула и доставља терет кортексу ћелије преко механизма истовара.[8][9]
Структура
[уреди | уреди извор]Сваки молекул динеинског мотора је сложени протеински скуп који је састављен од многих мањих полипептидних чланова. Цитоплазматски и аксонемски динеин садрже неке истоветне компоненте, али и неке јединствене, њима својствене, чланове.
Цитоплазматски динеин
[уреди | уреди извор]
Цитоплазматски динеин, који има молекуларну масу од око 1,5 мегадалтона (МДА), је динеин, који садржи око 12 полипептидних јединица: два идентична „тешка ланца", масе 520 кДа, који имају АТП-азну активност и одговорност за стварање покрета уз микротубуле; са два средња ланца, од 74 кДа за која се верује да фиксирају динеин за његов терет; два 53-59 кДа лака интермедијарна ланца и неколико лаких ланаца.
АТП-азна активност ствара силу сваком од тешких ланца динеина, тако да му је глава у облику велике крофне, која се односи на остале ААА протеине, док су две пројекције коке полазе из главе спојнице за друге цитоплазматске структуре. Једна пројекција, смотани калем петељке, веже микротубуле и „шета" по површини, понављајући циклус отпуштања и поновног везивања. Друга пројекција, проширени реп, веже се за лаки интермедијарни ланац коме предаје динеински терет. У наизменичној активности упарених тешких ланаца, комплетан цитоплазматски диинеински мотор омогућава једној динеинској молекули за транспорт да „однесе“ свој товар на значајне удаљености дуж микротубула, док се они потпуно не одвоје.
Квашчев динеин може прошетати уз микротубуле без скидања, али код метазоа, цитоплазматске динеин мора бити активиран везивањем динацтина, још једне субјединице већег протеина који је од суштинске важности за митозу и адаптер терета.[10]
Троструки комплекс, који укључује динеин, динактин и теретни адаптер, је ултра-процесиван и може прећи велике удаљености без скидања терета, како би стигао у међућелијско одредиште товара. Досад су идентификовани укључени терет и адаптери: БицД2, Хоок3, ФИП3и Спиндлy.[10] Лаки интермедијарни ланац, који посредује у привезивању интермедијарног ланца неколико адаптера терета за динеински мотор.[11] Друге репне подјединице могу такођер помагати у обликовању ове интеракције која је евидентирана у ниско резолутним структурама динеин-динактин-БицД2.[12]
Аксонемни динеин
[уреди | уреди извор]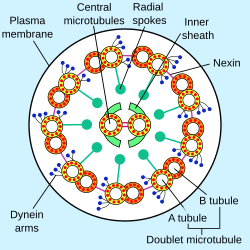
Аксонемни динеини јављају се у више облика јер садрже било један, два или три неидентична тешка ланце (зависно од организма и локације у трепљи). Сваки тешки ланац има лоптасти моторни домен са структуром у облику крофне, а верује се да подсећају на друге ААА протеине – спиралне завојнице „петељке" која се веже за микротубуле, а проширени реп (или „стем") се спаја са суседном микротубулом исте аксонеме. Свака динеински молекул на тај начин ствара унакрсни мост између две суседна микротубуле трепљине аксонеме. Током „електричног удара", који узрокује кретање, ААА АТП-азни моторни домен подлеже промени конформације, која узрокује везивање петељке за микротубуле окретањем у односу на репно везање терета, уз резултат да укључене микротубуле клизе у односу на остале. Ово клизање производи савијање, покрет који је потребан за трепљу да савлада и покрене ћелију или друге честице. Групе динеинских молекула које су одговорне за кретање у супротним смеровима веројатно се ускоро и инактивирају на координиран начин, тако да се цилија или флагела може кретати и уназад.[13]
Сегрегација хромозома током мејозе
[уреди | уреди извор]Сегрегација хомологних хромозома на супротним половима ћелије јавља се током прве поделе у мејози (мејоза I).[14][15][16][17]
Правилна сегрегација је од суштинске важности за производњу хаплоида – мејотских производа са нормалним (једноструким) комплементом хромозома. Формирају се на хијазми, месту дођађања рекомбинације делова хомологних хромозома. Међутим, у фисији квасца, када нема хијазми, сегрегацију промовише динеин. За хромозомске сегрегације потребан је Дхц1, моторна подјединица динеина, у присуству и одсуству хијазми. За сегрегацију је такођер потребан и лаки ланац Длц1 протеина, посебно када нема хијазми.[18][18]
Галерија
[уреди | уреди извор]Види још
[уреди | уреди извор]Извори
[уреди | уреди извор]- ^ а б ГМ., C., А Молецулар Аппроацх. 2нд едитион. Сундерланд (МА): Синауер Ассоциатес; Мицротубуле Моторс анд Мовементс. Тхе Целл:, 2000
- ^ а б в Карп, Гералд; Бегиннен, Курт; Вогел, Себастиан; Сусанне Кухлманн-Криег (2005). Молекуларе Зеллбиологие (на језику: француски). Спрингер. ИСБН 978-3-540-23857-7.
- ^ Самора, ЦП; Могессие, Б; Цонwаy, L; Росс, ЈЛ; Страубе, А; МцАинсх, АД (2011). „МАП4 анд ЦЛАСП1 операте ас а сафетy мецханисм то маинтаин а стабле спиндле поситион ин митосис.”. Натуре Целл Биологy. 13 (9): 1040—50. ПМИД 21822276. дои:10.1038/нцб2297.
- ^ Киyомитсу, Томоми; Иаин M. Цхеесеман (2012-02-12). „Цхромосоме- анд спиндле-поле-деривед сигналс генерате ан интринсиц цоде фор спиндле поситион анд ориентатион”. Натуре Целл Биологy. ИССН 1465-7392. дои:10.1038/нцб2440. Приступљено 2012-02-14.
- ^ Есхел, D.; Уррестаразу, L. А.; Виссерс, С.; Јауниауx, Ј. C.; ван Влиет-Реедијк, Ј. C.; Планта, Р. Ј.; Гиббонс, I. Р. (1993-12-01). „Цyтопласмиц дyнеин ис реqуиред фор нормал нуцлеар сегрегатион ин yеаст”. Процеедингс оф тхе Натионал Ацадемy оф Сциенцес оф тхе Унитед Статес оф Америца. 90 (23): 11172—11176. ИССН 0027-8424. ПМЦ 47944
 . ПМИД 8248224.
. ПМИД 8248224.
- ^ Ли, Y. Y.; Yех, Е.; Хаyс, Т.; Блоом, К. (1993-11-01). „Дисруптион оф митотиц спиндле ориентатион ин а yеаст дyнеин мутант”. Процеедингс оф тхе Натионал Ацадемy оф Сциенцес оф тхе Унитед Статес оф Америца. 90 (21): 10096—10100. ИССН 0027-8424. ПМЦ 47720
 . ПМИД 8234262.
. ПМИД 8234262.
- ^ Царминати, Ј. L.; Стеарнс, Т. (1997-08-11). „Мицротубулес ориент тхе митотиц спиндле ин yеаст тхроугх дyнеин-депендент интерацтионс wитх тхе целл цортеx”. Тхе Јоурнал оф Целл Биологy. 138 (3): 629—641. ИССН 0021-9525. ПМЦ 2141630
 . ПМИД 9245791.
. ПМИД 9245791.
- ^ Лее, Wеи-Лих; Оберле, Јессица Р.; Цоопер, Јохн А. (2003-02-03). „Тхе роле оф тхе лиссенцепхалy протеин Пац1 дуринг нуцлеар мигратион ин буддинг yеаст”. Тхе Јоурнал оф Целл Биологy. 160 (3): 355—364. ИССН 0021-9525. ПМЦ 2172672
 . ПМИД 12566428. дои:10.1083/јцб.200209022.
. ПМИД 12566428. дои:10.1083/јцб.200209022.
- ^ Лее, Wеи-Лих; Каисер, Мицхелле А.; Цоопер, Јохн А. (2005-01-17). „Тхе оффлоадинг модел фор дyнеин фунцтион: дифферентиал фунцтион оф мотор субунитс”. Тхе Јоурнал оф Целл Биологy. 168 (2): 201—207. ИССН 0021-9525. ПМЦ 2171595
 . ПМИД 15642746. дои:10.1083/јцб.200407036.
. ПМИД 15642746. дои:10.1083/јцб.200407036.
- ^ а б МцКеннеy, Рицхард Ј.; Хуyнх, Wалтер; Таненбаум, Марвин Е.; Бхабха, Гира; Вале, Роналд D. (2014-07-18). „Ацтиватион оф цyтопласмиц дyнеин мотилитy бy дyнацтин-царго адаптер цомплеxес”. Сциенце. 345 (6194): 337—341. ИССН 0036-8075. ПМЦ 4224444
 . ПМИД 25035494. дои:10.1126/сциенце.1254198.
. ПМИД 25035494. дои:10.1126/сциенце.1254198.
- ^ Сцхроедер, Цоуртнеy M.; Острем, Јонатхан ML; Хертз, Ницхолас Т.; Вале, Роналд D. (2014-10-01). „А Рас-лике домаин ин тхе лигхт интермедиате цхаин бридгес тхе дyнеин мотор то а царго-биндинг регион”. еЛифе. 3: е03351. ИССН 2050-084X. ПМЦ 4359372
 . ПМИД 25272277. дои:10.7554/еЛифе.03351.
. ПМИД 25272277. дои:10.7554/еЛифе.03351.
- ^ Урнавициус, Линас; Зханг, Каи; Диамант, Аристидес Г.; Мотз, Царина; Сцхлагер, Маx А.; Yу, Минмин; Пател, Нисха А.; Робинсон, Царол V.; Цартер, Андреw П. (2015-03-27). „Тхе струцтуре оф тхе дyнацтин цомплеx анд итс интерацтион wитх дyнеин”. Сциенце. 347 (6229): 1441—1446. ИССН 0036-8075. ПМЦ 4413427
 . ПМИД 25814576. дои:10.1126/сциенце.ааа4080.
. ПМИД 25814576. дои:10.1126/сциенце.ааа4080.
- ^ Кинг СМ (август 2012). „Интегратед цонтрол оф аxонемал дyнеин ААА(+) моторс”. Јоурнал оф Струцтурал Биологy. 179 (2): 222—8..
- ^ Цампбелл Н. А.; et al. (2008). Биологy. 8тх Ед. Персон Интернатионал Едитион, Сан Францисцо. ИСБН 978-0-321-53616-7.
- ^ Софраџија А., Шољан D., Хаџиселимовић Р. (2004). Биологија 1. Свјетлост, Сарајево. ИСБН 9958-10-686-8.
- ^ Албертс Б.; et al. (2002). Молецулар Биологy оф тхе Целл, 4тх Ед. Гарланд Сциенце. ISBN 978-0-8153-4072-0.
- ^ Бајровић К, Јеврић-Чаушевић А., Хаџиселимовић Р., Едс. (2005). Увод у генетичко инжењерство и биотехнологију. Институт за генетичко инжењерство и биотехнологију (ИНГЕБ) Сарајево. ИСБН 9958-9344-1-8.
- ^ а б Давис L, Смитх ГР (2005). „Дyнеин промотес ацхиасмате сегрегатион ин Сцхизосаццхаромyцес помбе”. Генетицс. 170 (2): 581—90. ПМЦ 1450395
 . ПМИД 15802518. дои:10.1534/генетицс.104.040253.
. ПМИД 15802518. дои:10.1534/генетицс.104.040253.
Литература
[уреди | уреди извор]- Карп Г. (2005). Целл анд Молецулар Биологy: Цонцептс анд Еxпериментс (4тх изд.). Хобокен, Њ: Јохн Wилеy анд Сонс. стр. 346—358. ISBN 978-0-471-19279-4.
- Schroer, TA (2004). „Dynactin”. Annu. Rev. Cell Dev. Biol. 20: 759—79. PMID 15473859. doi:10.1146/annurev.cellbio.20.012103.094623.
- Goodenough, U.W., Cilia, flagella and the basal apparatus (1989). Curr Opin Cell Biol. 1 (1). Недостаје или је празан параметар
|title=(помоћ)p. 58-62.
Spoljašnje veze
[уреди | уреди извор] | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |