Fibrilacija srčanih pretkomora
| Fibrilacija srčanih pretkomora | |
|---|---|
 | |
| Klasifikacija i spoljašnji resursi | |
| Specijalnost | kardiologija |
| Patient UK | [https://patient.info/doctor/atrial-fibrillation-pro atrial-fibrillation-pro Fibrilacija srčanih pretkomora] |
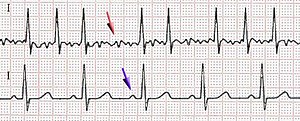
Fibrilacija srčanih pretkomora, pretkomorsko treperenje, atrijalna fibrilacija (AF) je dugotrajni poremećaj srčanog ritma koji se manifestuje tahiaritmijom pretkomora i posledičnim poremećajem mehaničkih funkcije pretkomora. Nastaje kao posledica neusklađene depolarizacija srčanih pretkomora koje su najčeščće udružene sa strukturnim srčanih bolesti, mada se kod znatnog broja bolesnika ne može detektovati organsko oboljenje srca. Elektrokardiografski se toko pretkomorskih fibrilacije, umesto postojanih R-talasa, na snimku beleže brze oscilacije ili fibrilatorni talasi koji su promenljivi u veličini, obliku i vremenu javljanja. Kada je očuvano pretkomornokomorsko (atrioventrikularno) sprovođenje električnih impulsa, ovaj poremećaj ritma pretkomora je udružen sa nepravilnim, često veoma brzim odgovorom srčanih komora.[1]
Komplikacije koje mogu nastati u toku pretkomorskog treperenje, kao što su hemodinamski poremećaji (koje čine gubitak usaglašene pretkomorske mehaničke aktivnosti, nepravilnost komorskog odgovora, brza srčana frekvencija) i tromboembolija mogu značajno uticati na porast morbiditeta, mortaliteta i troškove zdravstvenog zbrnjavanja, jer su prisutne kod oko 1/3 svih bolnički lečenih lica sa poremećajima srčanog ritma.[2] [3][4][5][6]
Tokom prvih decenija 21. veka, hospitalizacija bolesnika sa AF porasla je za 66%. Godišnji troškovi lečenje ove bolesti su oko $ 3.600 po pacijentu, što AF stvalja u grupu najskupljih javnih zdravstvenih problema. Iako direktno ne ugrožava život, AF značajno povećava ukupni mortalitet, pre svega od kardiovaskularnih bolesti, kao što su srčane insuficijencije, i od primarnog su značaja za nastanak moždanog udara.[7]
Epidemiologija[uredi | uredi izvor]
Fibrilacija srčanih pretkomora (AF) spada u grupu najčešćih aritmija u kliničkoj praksi, jer se prema istraživanjima, javlja kod oko trećine hospitalizovanih bolesnika zbog poremećaja ritma srca. Većina podataka o epidemiologiji, prognozi i kvalitetu života bolesnika sa AF potiče iz Severne Amerike i Zapadne Evrope. Tako se procenjuje da oko 2,2 miliona Amerikanaca ima paroksizmalnu ili perzistentnu AF. Učestalost AF kod bolesnika bez ranije konstatovanih plućno–srčanih bolesti, u jednim studijama je manja od 12% u odnosu na sve slučajeve AF. Međutim, u nekim drugim studijama učestalost je bila preko 30%. Fibrilacija srčanih pretkomora je česta kod bolesnika sa kongestivnom srčanom insuficijencijom i u bolestima srčanih zalistaka, sa kojima je u direktnoj je sprezi u zavisnosti od težine ovih bolesti.[8]
Fibrilacija srčanih pretkomora predstavlja veliki finansijski problem u sistemu javnog zdravstva, oko 3.600 USA $ godišnje po bolesniku; a ukupni troškovi prelaze oko 15,7 milijardi USA $ i u Evropskoj uniji, [9]
Procene predviđaju da će 12 miliona ljudi u SAD imati AF do 2030. godine i da će skoro pola miliona ljudi godišnje biti hospitalizovano samo u SAD, među kojima će biti sve više smrtnih slučajeva svake godine.[10]
- Prevalencija
Na globalnom nivou, procenjuje se da je prevalencija fibrilacija srčanih pretkomora 0,4% do 1%, u opštoj populaciji i povećava se sa starenjem, pa je tako u odnosu na broj godina života:
- kod osoba mlađih od 60 godina prevalencija AF je manja od 1%
- kod osoba starijih od 80 godina prevalencija AF je veća od 10%
Prevalencija AF je veća kod muškaraca, kod kojih je skoro udvostručila tokom jedne generacije, nego kod žena istih godina starosti, gde je prevalanca ostala na istom nivou.
Neki istraživači su AF nazvali „novom epidemijom kardiovaskularnih bolesti 21. veka“, koja je najčešća među starijim osobama. Preko 33 miliona ljudi starijih od 55 godina je dijagnostifikovano širom sveta.[10] Prosečna starost bolesnika sa AF je oko 75 godina. Oko 75 godina starosti broj muškaraca i žena sa AF je skoro jednak, dok oko 60% bolesnika preko 75 godina čine žene.[11][12]
Procenjeno je da se fibrilacija srčanih pretkomora javlja kod oko 4% ukupne populacije odraslih i da pogađa oko 2,2 miliona ljudi u Sjedinjenim Američkim Državama. Oko 160.000 novih slučajeva fibrilacija srčanih pretkomora dijagnostikuje se svake godine u SAD.[12]
- Incidencija
Na osnovu prospektivnih studija sprovedenim u razvijenijim zemljama sveta, incidencija pretkomorske fibrilacije se povenava od 0,1% godišnje kod mlađih od 40 godina do preko 1,5% godišnje kod žena starijih od 80 godina i preko 2% odsto godišnje kod muškaraca iznad 80 godina života.[13]
U Framingamskoj studiji (prilagođenoj životnom dobu) utvrđeno je da se incidencija povenala u toku tridesetogodišnjeg praćenja. Na osnovu ovih podataka može se zaključiti kakav značaj može imati AF u budućnosti.[14]
Nakon tridesetosmogodišnjeg trajanja Framingamske studije, utvrđeno je je učestalost srčane insuficijencije na početku, u muškaraca kod kojih se razvila pretkomorska fibrilacija, bila 20,6%, dok je samo 3,2% bolesnika bez ovog poremećaja ritma imalo kongestivnu srčanu insuficijenciju; a analogna incidencija kod ženaa bila je 26,0%, odnosno 2,9%.[14]
- Mortalitet
Stopa smrtnosti bolesnika sa pretkomorskom fibrilacijom udvostručena je u odnosu na bolesnike u sinusnom ritmu i najčešće je povezana sa težinom osnovnog srčanog oboljenja.
Tokom 8,6 meseci praćenja, ALFA studija je utvrdila da je mortalitet 3,7%, a od toga je oko 2/3 smrti bilo izazvano srčanosudovnom bolestima. Kod bolesnika sa blagom do umerenom srčanom insuficijencijom podaci su neujednačeni.[15]
U studiji V-HeFT (Veterans Administration Heart Failure Trials) nije pronađeno povećanje smrtnosti među bolesnicima sa pretkomorskom fibrilacijom. U studiji SOLVD (Studies od Left Ventricular Dysfunction) mortalitet je bio 34% kod bolesnika sa pretkomorskom fibrilacijom, nasuprot 23% kod bolesnika u sinusnom ritmu. Ova razlika se može objasniti većom smrtnošću bolesnika sa srčanom insuficijencijom nego bolesnika sa tromboembolijom.[16]
- Polne i rasne razlike
Fibrilacija srčanih pretkomora javlja se oko 1,5 puta češće kod muškaraca nego kod žena.[12]
Na osnovu ograničenih podataka iz literature, može se zaključiti da je rizik od razvoja AF, prema životnom dobu, upola manji kod osoba crne nego kod osoba bele rase.[14]
Klasifikacija[uredi | uredi izvor]
Klinička slika AF kod dokazanog ili nedokazanog srčanog oboljenja, ispoljava se na različite načine sa odgovarajućim simptomima ili bez njih. Za fibrilaciju srčanih pretkomora predlagani su različiti klasifikacioni sistemi.[17]
- Jedna od klasifikacija AF zasniva se na elektrokardiografskom nalazu.
- Druga od klasifikacija AF zasniva na epikardijalnom[18] i endokardijalnom mapingu električne aktivnosti pretkomora.
Do sada je predložen veći broj kliničkih klasifikacija, ali nijedna u potpunosti ne odgovara svim oblicima fibrilacije srčanih pretkomora, jer po smatranju mnogih kardiologa;
| „ | Klinički upotrebljivi, klasifikacioni sistem moraju biti zasnovan na dovoljnom broju kliničkih karakteristika, i moraju biti takvi da se iz njih mogu izvesti specifični terapijski zaključci. | ” |
Oblik AF najčešće se definiše brojem epizoda (koje se mogu spontano prekinuti ili je za njeno zaustavljanje neophodna medicinska intervencija), trajanjem, učestalošću, načinom započinjanja, mogućim „pokretačima“ i odgovorom na terapiju. Ove osobine je nemoguće odrediti kada se prvi put postavlja dijagnoza AF. Iako se oblik aritmije može menjati tokom vremena, opisivanje aritmije u datom trenutku ima poseban klinički značaj.
Za označavanje različitih oblika AF, korišćeni su brojni termini za kao što su akutna, hronična, paroksizmalna, intermitentna, konstantna, perzistentna i permanentna fibrilacija srčanih pretkomora. Nepreciznost ovakvih definicija otežava uporđenje uspešnosti terapije u raznim studijama. U ovom tekstu primenjena je klasifikacija Američkog udruženja kardiologa, „koja pretenduje da bude jednostavna i lako primenljiva“:
- Primarna AF
Kada se kod bolesnik javljaju dve ili više epizoda takva AF se označava kao ponavljajuća ili rekurentna. Ako se aritmija zaustavlja spontano, rekurentna AF se označava kao paroksizmalna; kada je neprekidna, AF se oznaaava kao perzistentna. Ako je AF perizistentna , uspešno terapija lekovima ili električnom kardioverzijom ne menja nomenklaturu.

Perzistentna fibrilacija srčanih pretkomora može biti, ili prva prezentacija aritmije, ili predstavlja progresiju povratnih (rekurentnih) epizoda paroksizmalne AF. U perzistentnu atrijalnu fibrilaciju spada i dugotrajna AF (trajanja preko jedne godine), tokom koje kardioverzija nije bila indikovana ili nije pokušavana, a to obično vodi ka permanentnoj AF. Termini, definisani u prethodnom pasusu, primenjuju se na epizode AF koje traju preko 30 sekundi i koje nisu izazvane reverzibilnim uzrokom.
- Sekundarna AF
U sklopu akutnog infarkta miokarda, perikarditisa, plućne embolije, pneumonije ili akutne bolesti pluća, kardiohirurških zahvata, miokarditisa, hipertireoidizma, moće se javiti sekundarna AF, koja se razmatra posebno, zato što postoji manja verovatnoća da se AF ponovi kada se jednom primarni poremećaj koji je je doveo do tog stanja otkloni. U ovim situacijama,AF nije primarni problem, i lečenje osnovnog poremećaja, uporedno sa lečenjem epizode AF, obično dovodi do zaustavljanja aritmije srca bez njenog ponavljanja.
- „Lone AF“
Termin “Lone AF” ili u bukvalnom prevodu „usamljena AF“ se različito definiša, ali se ona generalno primenjuje na osobe mlađe od 60 godina, bez kliničkih i ehokardiografskih dokaza srčanoplučnog oboljenja.[19] Kod ovih bolesnika je povoljna prognoza tromboembolizma i mortaliteta. Međutim, starenjem i razvojem teških abnormalnosti, kao što je uvećanje leve pretkomore, bolesnici više ne spadaju ovu kategoriju, a rizici od pojave tromboembolije i smrtnog ishoda se povećavaju. “Lone AF” se razlikuje od ostalih oblika idiopatske AF po starosti bolesnika i odsustvu strukturnih srčanosudovnih promena.
Nevalvularna AF označava pojavu ovog poremećaja ritma kada kod bolesnika ne postoji reumatska bolest mitralnog zalistka i veštački srčani zalistak.
Patofiziologija[uredi | uredi izvor]
- Patoanatomske promene kod AF
I pored brojnih studija, podaci o anatomskim promenama kod bolesnike sa perzistentnom fibrilacija srčanih pretkomora su nepotpuni, jer strukturalne abnormalnosti srčanih pretkomora prevazilaze promene uzrokovane osnovnim oboljenjem srca. Histološki pregled, kod većine bolesnika, pokazuje mestimičnu fibrozu sa susednim normalnim i obolelim pretkomorskim mišićnim vlaknima, što može biti uzrok nehomogene refrakternosti pretkomora.[20] Masna degeneracija i Fibroza mogu, zahvatiti sinusni čvor, što se objašnjava reakcijom na zapaljenjske ili degenerativne procese koje je teško utvrditi. U patogenezi pretkomorske fibrilacije još uvek nije utvrđena uloga zapaljenjskog procesa. U 66% biopsijom prekomora uzetih uzoraka, histološke promene identične miokarditisu otkrivene su kod bolesnika sa „lone AF”. Infiltracija mišića pretkomora može da se pojaviti kod amiloidoze, sarkoidoze i hemohromatoze.[21]
Hipertrofija pretkomorskih vlakana najčešće se opisuje kao osnovna karakteristika, a ponekad i kao izolovana histološka promena kod bolesnika sa pretkomorskom fibrilacijom. Perzistentne atrijalne fibrilacije, može biti i posledica hipertrofija i proširenja pretkomora, s obzirom na ehokardiografski opis progresivnog uvećanja pretkomora kod bolesnika sa AF. Nedavnom eksperimentalnom studijom pokazano je da srčana insuficijencija, posredstvom izražen intersticijalnom fibroze, olakšava započinjanje i održavanje pretkomorske fibrilacije.[22]
Ipak, kod većine bolesnika nije moguće otkriti osnovni anatomski proces odgovoran za pojavu aritmije. Visoka koncentracija antitela u serumu, protiv teških miozinskih lanaca kod bolesnika sa paroksizmalnom pretkomorskom fibrilacijom bez utvrođenog srčanog oboljenja, ukazuje na moguću ulogu autoimunskih mehanizama kod genetski predisponiranih bolesnika. Ovo objašnjava manju prevalenciju strukturnog srčanog oboljenja kod bolesnika sa paroksizmalnom pretkomorskom fibrilacijom u odnosu na bolesnike sa permanentnom pretkomorskom fibrilacijom.[23][24]
- Mehanizmi AF
Teorije o mehanizmu AF obuhvataju dva osnovna procesa:
- Povećan automatizam jednog ili više brzo depolarizujućih žarišta,[25]
- Kružno kretanje drži (reentri) u jednom ili više krugova.[26]
Žarišno poreklo AF navodi se u podacima dobijenim na eksperimentalnim modelim fibrilacija srčanih pretkomora indukovanih akonitinom i elektrostimulacijom, u kojima se aritmija održavala samo u izolovanim regionima mišića pretkomora. Pretkomorska žarišta povećanog automatizma, koji su najčešće smešteni u gornjim plućnim venama, mogu započeti AF kod predisponiranih bolesnika. Bolesnici mogu imati više žarišta u predelu plućnih vena, sposobnih da izazovu AF. Žarišta se takođe mogu nalaziti u desnoj pretkomori, ređe, u gornjoj šupljoj veni i koronarnom sinusu. Histološke studije su pokazale postojanje pretkomorskog mišićnog tkiva očuvanih elektrofizioloških osobina, koje se proteže i u plućne vene, mada je nejasno da li ovo predstavlja poseban oblik AF ili pokretačku aritmiju, a nije ni dovoljno utvrđen značaj mehanizma indukcije među raznim podgrupama bolesnika sa AF. Najverovatnije da je žarišni razvoj AF važnije kod bolesnika sa paroksizmalnom u odnosu na bolesnike sa perzistentnom AF, i da ablacija ovakvih žarišta može biti način lečenja.

(B) Višestruki reentri: depolarizacioni talasi nasumice ponovo ulaze u tkivo, koje je prethodno bilo aktivirano njima ili nekim drugim depolarizacionim talasom. Pri čemu putanja depolarizacionog talasa varira.[27]
Moe i saradnici su prvi uveli hipotezu višestrukog kružnog kretanja draži kao mehanizma reentri AF, i izneli pretpostavku da kao posledica frakcionisanja osnovnog talasa depolarizacije, u toku njegove prostiranje kroz pretkomore, provocira nastanak više samoodržavajućih „talasića - potomaka“ koji se kružno kreće. Broj kružnih tokova draži u svakom trenutku zavisi od refrakternog perioda, mase srčanog mišića i brzine sprovođenja u različitim delovima pretkomora. Povećana masa pretkomora sa kratkim refrakternim periodom i usporenim sprovođenjem može omogućiti istovremeno postojanje većeg broja kružnih puteva draži, podržvajući dugotrajnu AF. Istovremeno snimanje električne aktivnosti, pomoću više elektroda, potvrdilo je ovu hipotezu u istraživanjima kod pasa i čoveka.[28][29]
Anatomski i elektrofiziološki faktori u nastanku i/ili održavanju Fibrilacije srčanih pretkomora
| Anatomski faktori | Elektrofiziološki faktori |
|---|---|
|
|
Klinička slika[uredi | uredi izvor]
Kliničke manifestacije fibrilacije srčanih pretkomora mogu biti: simptomatske i asimtomatske, ponekad i kod istog bolesnika. To zavisi od toga koliko srčane komore brzo kucaju. Ako srce kuca normalnim ili blago povišenim tempom, verovatno pacijent nećete ništa osetiti. Ali ako srčane komore kucaju brže, onda pacijent počinje da primećujete simptome. Ponekad prva manifestacija aritmije može biti izazvane embolijom ili pogoršanjem srčane insuficijencije.
Simptomi kod bolesnika su različiti i uglavnom variraju sa promenom srčane frekvencije, osnovnim funkcionalnim stanjem organizma, trajanjem AF i karakteristikama bolesnikove percepcije. U kliničkoj slici najčešće dominiraju sledeći znaci i simptomi:
- Palpitacije u predelu srca, bol u grudima, otežano disanje, lakše zamaranje, nesvesticu ili sinkopu (kratkotrajan gubitak svesti). Na ove simptome žali se najveći broj bolesnika sa fibrilacije srčanih pretkomora.
- Pojava poliurije koju kod AF može izazvati oslobađanje pretkomorskog natriuretskog peptida.
- Fibrilacije srčanih pretkomora sa brzim odgovorom srčanih komora, koja može da izazove kardiomiopatije izazvane tahikardijom, posebno kod bolesnika koji nisu svesni aritmije.
- Sinkopa je retka, ali može imati ozbiljne komplikacije, koje su najčešće udružena sa oboljenjem sinusnog čvor ili hemodinamskom opstrukcijom kod stenoze zalistaka aorte i hipertrofične kardiomiopatije, zatim sa moždanosudovnom bolešću ili postojanjem aberantnog puta.
Terapija[uredi | uredi izvor]
Osnovni ciljevi lečenja bolesnika sa atrijalnom fibrilacijom odnose se na samu aritmiju i na prevenciju tromboembolijskih komplikacija. Kod pacijenata sa upornim atrijalne fibrilacije postoje dva osnovna pristupa u lečenje aritmije:
- Strategija kontrole ritma – koja ima za cilj da se što pre povrati normalan sinusni ritam srca kardioverzijom, a zatim spreči recidiv AF;
- Strategija kontrole srčane frekvencije – koja ima za cilj održavanje AF uz smanjenje učestalosti ventrikularnih kontrakcija izazvanih lekovima.
Kontrola ritma naspram kontrole srčane frekvencije
Odluka da se pokuša konverzija AF (u odnosu na opciju prihvatanja AF uz kontrolu ventrikularnog pulsa) donosi se sa namerom da se otklone svi ovi problemi, ali su dokazi koji potvrđuju u kojoj se meri uspostaljnje i održavanje sinusni ritam za postizanje ovog cilja – oskudni.[1]
Konverzija i održavanje sinusnog ritma nudi teorijske prednosti u u smislu smanjenja rizika od tromboembolijskih komplikacija i posledično smanjenja potrebe za hroničnom antikoagulansnom terapijom, ali se lekovi za kontrolu ventrikularnog pulsa generalno smatraju bezbednijim od onih sa antiaritmičkim efektima. Relativna vrednost ova dva pristupa – kontrola ritma naspram kontrole frekvencije – i danas je predmet brojnih kliničkih studija.[1] Ograničeni dostupni podaci ukazuju da nijedan pristup nema jasnu prednost u odnosu na druge pa se nadamo da će rezultati pomenutih studija dati potpuniji odgovor.[1]
Antikoagulantna terapija[uredi | uredi izvor]
I kod jedne i kod druge strateggine radi prevencije tromboembolije sprovodi se i antikoagulantna terapija.
Antikoagulantna terapija je neophodna da bi se sprečila najteža komplikacija AF, tromboembolija. U tu svrhu se koriste oralni antikoagulansi (varfarin , rivaroksaban (ksarelto, apiksaban , dabigatran ) ili acetilsalicilna kiselina (ili klopidogrel).
Indikacije za antikoagulaciju i izbor leka određuju rizik od tromboembolije, koji se izračunava pomoću CHADS2 ili CHA2DS2-VAS ckala:
- Ako je ukupan rezultat na skali CHADS2 ≥ 2, onda je u odsustvu kontraindikacija indikovana dugotrajna terapija oralnim antikoagulansima (na primer, varfarin sa održavanjem INR od 2-3 ili novim oralnim antikoagulansima).
- Ako je ukupan skor na skali CHADS2 0-1, preporučuje se preciznija procena rizika od tromboembolije uz pomoć CHA2DS2-VAS skale.
- Ako je ukupan skor ≥ 2 poena, propisuju se oralni indirektni antikoagulansi, 1 bod - oralni indirektni antikoagulansi (poželjno) ili acetilsalicilna kiselina 75-325 mg dnevno, 0 poena - antikoagulantna terapija nije potrebna (poželjno) ili acetilsalicilna kiselina u istu dozu.
Međutim, antikoagulantna terapija je rizična jer može da izazove krvarenje. U tom smislu korstu se HAS-BLED skala, koja je razvijena da proceni rizik od ove komplikacije. Ako je skor ≥ 3 na HAS-BLED skali to ukazuje na visok rizik od krvarenja. U tim slučajevima upotreba bilo kog antitrombotičkog leka zahteva poseban oprez.[30]
Skale za kliničko predviđanje i procenu rizika od moždanog udara kod AF[uredi | uredi izvor]
| Faktor rizika | Bodovi | |
|---|---|---|
| C | Congestive heart failure (Hronična srčana insuficijencija) | |
| H | Hypertension (Arterijska hipertenzija) | |
| A | Age (Starost) ≥ 75 godina | |
| D | Diabetes mellitus Šećerna bolest | |
| S2 | Stroke or TIA (Moždani udar ili tranzitorni ishemički atak u anamnezi ) |
| Faktor rizika | Bodovi | |
|---|---|---|
| C | Congestive heart failure or Left ventricular systolic dysfunction (Kongestivna srčana insuficijencija ili sistolna disfunkcija leve komore) | |
| H | Hypertension (Arterijska hipertenzija) | |
| A2 | Age (Starost) ≥ 75 godina | |
| D | Diabetes mellitus (Šećerna bolest) | |
| S2 | Stroke or TIA or thromboembolism (Moždani udar ili TIA ili tromboembolija) | |
| V | Vascular disease (Vaskularne bolesti, ili bolest perifernih arterija, infarkt miokarda, ateroskleroza aorte) | |
| A | Age (starost) 65—74 godina | |
| Sc | Sex category (ženski pol) |
Prognoza[uredi | uredi izvor]
- Među bolesnicima upućenim na lečenje zbog srčane insuficijencije, incidencija pretkomorske fibrilacije, tokom 2 do 3 godine praćenja, bila je 5-10%.
- Incidencija pretkomorske fibrilacije može da bude i manja kod bolesnika sa srčanom nsuficijencijom ako su se više godina lečili inhibitorima angiotenzin - konvertujućeg enzima.[31]
- Među bolesnicima sa nereumatskom atrijalna fibrilacijom, učestalost ishemijskog moždanog udara prosečno je 5% godišnje, što je između dva i sedam uta više nego kod osoba bez pretkomorske fibrilacije. Svaki šesti moždani udar javlja se kod bolesnika sa pretkomorskom fibrilacijom.[32]
- Kada se uzmu u obzir i tranzitorni ishemijski ataci i klinički skriveni ili „nemi“ moždani udari (otkkriveni radiografskim snimanjem), stopa moždane ishemije koja prati nevalvularnu fibrilaciju pretkomora prelazi 7% godišnje.[33]
- U bolesnika sa reumatskom bolešću srca i pretkomorskom fibrilacijom, praćenih u Framingamskoj studiji, rizik od moždanog udara bio je 17 puta veći u poređenju sa odgovarajućom kontrolnom grupom iste starosti, dok je ovaj rizik bio pet puta veći u odnosu na bolesnike sa nereumatskom pretkomorskom fibrilacijom.[34]
- Fibrilacija srčanih pretkomora udvostručava rizik od moždanog udara, nezavisno od ostalih faktora rizika u Manitoba Follow-up studiji. Relativni rizik za moždani udar pri nereumatskoj pretkomorskoj fibrilacija bio je 6,9% u Whitehall studiji i 2,3% u Regional Heart studiji.[35]
- Francuska ALFA studija je, među bolesnicima sa pretkomorskom fibrilacijom, tokom srednjeg vremena praćenja od 8,6 meseci, utvrdila incidenciju tromboembolija od 2,4%.
- Rizik od moždanog udara povećava se sa starenjem; u Framingamskoj studiji godišnji rizik od moždanog udara koji se pripisuje pretkomorskoj fibrilacija povećavao se, od 1,5% kod bolesnika u životnoj dobi od 50 do 59 godina, na 23,5% u bolesnika u životnoj dobi između 80 i 89 godina.[32]
Vidi još[uredi | uredi izvor]
Izvori[uredi | uredi izvor]
- ^ a b v g Radna grupa Američkog koledža za kardiologiju i Američkog udruženja za srce za atrijalnu fibrilaciju, PREPORUKE ZA LEČENJE ATRIALNE FIBRILACIJE, prevod originala objavljenog U:Eur Heart J. Fuster, V.; Rydén, L. E.; Asinger, R. W.; Cannom, D. S.; Crijns, H. J.; Frye, R. L.; Halperin, J. L.; Kay, G. N.; Klein, W. W.; Lévy, S.; McNamara, R. L.; Prystowsky, E. N.; Wann, L. S.; Wyse, D. G.; American College of Cardiology; American Heart Association; European Society of Cardiology; North American Society of Pacing and Electrophysiology (2001). „ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology” (PDF). European Heart Journal. 22 (20): 1852—1923. PMID 11601835. doi:10.1053/euhj.2001.2983. Arhivirano iz originala (PDF) 10. 09. 2014. g. Pristupljeno 28. 02. 2014. Kardiovaskularna medicina: Preporuke Arhivirano na sajtu Wayback Machine (10. septembar 2014)
- ^ Fuster V, Rydén LE, Cannom DS, et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 Guidelines for the Management of Patients With Atrial Fibrillation). J Am Coll Cardiol. 2006;48:e149-e246. Abstract
- ^ Fuster, V.; et al. (2001). „ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation: Executive summary. A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients with Atrial Fibrillation): Developed in Collaboration with the North American Society of Pacing and Electrophysiology”. J. Am Coll Cardiol. 38 (4): 1231—1266. PMID 11583910. doi:10.1016/S0735-1097(01)01587-X.
- ^ Wyse, D. G.; Waldo, A. L.; Dimarco, J. P.; Domanski, M. J.; Rosenberg, Y.; Schron, E. B.; Kellen, J. C.; Greene, H. L.; Mickel, M. C.; Dalquist, J. E.; Corley, S. D.; Atrial Fibrillation Follow-up Investigation of Rhythm Management (AFFIRM) Investigators (2002). „A comparison of rate control and rhythm control in patients with atrial fibrillation”. New England Journal of Medicine. 347 (23): 1825—1833. PMID 12466506. doi:10.1056/NEJMoa021328..
- ^ Van Gelder, I. C.; Hagens, V. E.; Bosker, H. A.; Kingma, J. H.; Kamp, O.; Kingma, T.; Said, S. A.; Darmanata, J. I.; Timmermans, A. J.; Tijssen, J. G.; Crijns, H. J.; Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group (2002). „A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation”. New England Journal of Medicine. 347 (23): 1834—1840. PMID 12466507. doi:10.1056/NEJMoa021375.
- ^ Kalman J, Kim Y-H, Klein G (2005). „Worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation”. Circulation. 111 (9): 1100—1105. PMID 15723973. S2CID 5901886. doi:10.1161/01.CIR.0000157153.30978.67.
- ^ Le Heuzey, Jean-Yves; Paziaud, Olivier; Piot, Olivier; Ait Said, Mina; Copie, Xavier; Lavergne, Thomas; Guize, Louis (2004). „Cost of care distribution in atrial fibrillation patients: The COCAF study”. American Heart Journal. 147 (1): 121—6. PMID 14691429. doi:10.1016/S0002-8703(03)00524-6.
- ^ Kopecky, S. L.; Gersh, B. J.; McGoon, M. D.; Whisnant, J. P.; Holmes Jr, D. R.; Ilstrup, D. M.; Frye, R. L. (1987). „The natural history of lone atrial fibrillation. A population-based study over three decades”. New England Journal of Medicine. 317 (11): 669—74. PMID 3627174. doi:10.1056/NEJM198709103171104..
- ^ Le Heuzey, J. Y.; Paziaud, O.; Piot, O.; Said, M. A.; Copie, X.; Lavergne, T.; Guize, L. (2004). „Cost of care distribution in atrial fibrillation patients: The COCAF study”. Am Heart J. 147 (1): 121—6. PMID 14691429. doi:10.1016/S0002-8703(03)00524-6.
- ^ a b „Atrial Fibrillation (Afib): Causes, Symptoms and Treatment”. Cleveland Clinic (na jeziku: engleski). Pristupljeno 2023-04-24.
- ^ Friberg, J.; Scharling, H.; Gadsbøll, N.; Jensen, G. B. (2003). „Sex-specific increase in the prevalence of atrial fibrillation (The Copenhagen City Heart Study)”. Am J Cardiol. 92 (12): 1419—23. PMID 14675577. doi:10.1016/j.amjcard.2003.08.050..
- ^ a b v Medifocus, Guidebook on Atrial Fibrillation Publisher: Medifocus.com, Inc. Last Updated: February 20, 2014, Number of Pages: 179 (Printed Format) Pristupljeno 2. 4. 2014.
- ^ Psaty, B. M.; Manolio, T. A.; Kuller, L. H.; Kronmal, R. A.; Cushman, M.; Fried, L. P.; White, R.; Furberg, C. D.; Rautaharju, P. M. (1997). „Incidence of and risk factors for atrial fibrillation in older adults”. Circulation. 96 (7): 2455—61. PMID 9337224. doi:10.1161/01.CIR.96.7.2455..
- ^ a b v Wolf PA, Abbott RD, Kannel WB (1991). „Atrial fibrillation as an independent risk factor for stroke: the Framingham Study”. Stroke. 22 (8): 983—8. PMID 1866765. S2CID 498613. doi:10.1161/01.STR.22.8.983.
- ^ Lévy, S.; Maarek, M.; Coumel, P.; Guize, L.; Lekieffre, J.; Medvedowsky, J. L.; Sebaoun, A. (1999). „Characterization of different subsets of atrial fibrillation in general practice in France: The ALFA study. The College of French Cardiologists”. Circulation. 99 (23): 3028—35. PMID 10368121. S2CID 40876883. doi:10.1161/01.CIR.99.23.3028..
- ^ Singh SN1, Fletcher RD, Fisher S, Lazzeri D, Deedwania P, Lewis D, Massie B, Singh BN, Colling C. Veterans Affairs congestive heart failure antiarrhythmic trial. CHF STAT Investigators. Am J Cardiol. 1993 Nov 26. . 72 (16): 99. Nedostaje ili je prazan parametar
|title=(pomoć)F-102F. - ^ Bellet S. Clinical Disorders of the Heart Beat. 3rd ed. Philadelphia: Lea & Febiger, 1971.
- ^ Allessie MA, Konings KT, Kirchhof CJ. Mapping of atrial fibrillation. In: Olsson SB, Allessie MA, Campbell RW, editors. Atrial Fibrillation: Mechanisms and Therapeutic Strategies. Armonk, NY: Futura, (1994), pp. 37–49.
- ^ Kopecky SL, Gersh BJ, McGoon MD,; et al. (1987). „The natural history of lone atrial fibrillation. A population-based study over three decades”. New England Journal of Medicine. 317 (11): 669—74. PMID 3627174. doi:10.1056/NEJM198709103171104.. Medline
- ^ Bharti S, Lev M. Histology of the normal and diseased atrium. In: Fall RH, Podrid PJ, editors. Atrial Fibrillation: Mechanism and Management. New York: Raven Press, (1992), pp. 15–39.
- ^ Allessie, M.; Ausma, J.; Schotten, U. (2002). „Electrical, contractile and structural remodeling during atrial fibrillation”. Cardiovasc Res. 54 (2): 230—46. PMID 12062329. doi:10.1016/S0008-6363(02)00258-4.
- ^ Pokharel, S.; Van Geel, P. P.; Sharma, U. C.; Cleutjens, J. P.; Bohnemeier, H.; Tian, X. L.; Schunkert, H.; Crijns, H. J.; Paul, M.; Pinto, Y. M. (2004). „Increased myocardial collagen content in transgenic rats overexpressing cardiac angiotensin-converting enzyme is related to enhanced breakdown of N-acetyl-Ser-Asp-Lys-Pro and increased phosphorylation of Smad2/3”. Circulation. 110 (19): 3129—35. PMID 15520311. S2CID 31889350. doi:10.1161/01.CIR.0000147180.87553.79..
- ^ Goette, A.; Staack, T.; Röcken, C.; Arndt, M.; Geller, J. C.; Huth, C.; Ansorge, S.; Klein, H. U.; Lendeckel, U. (2000). „Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation”. J. Am Coll Cardiol. 35 (6): 1669—77. PMID 10807475. doi:10.1016/S0735-1097(00)00611-2.
- ^ Kumagai, K.; Nakashima, H.; Urata, H.; Gondo, N.; Arakawa, K.; Saku, K. (2003). „Effects of angiotensin II type 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation”. J. Am Coll Cardiol. 41 (12): 2197—204. PMID 12821247. doi:10.1016/S0735-1097(03)00464-9.
- ^ Allessie MA, Kirchhof CJHJ, Bonke FIM. The role of the sinus node in supra ventricular arrhythmias. In: Mazgalev T, Dreifus LS, Michelson EL, eds. Electrophysiology of the Sinoatrial and Atrioventricular Nodes. New York: Alan R Liss; (1988), pp. 53–66.
- ^ Ortiz, J.; Niwano, S.; Abe, H.; Rudy, Y.; Johnson, N. J.; Waldo, A. L. (1994). „Mapping the conversion of atrial flutter to atrial fibrillation and atrial fibrillation to atrial flutter. Insights into mechanisms”. Circ Res. 74 (5): 882—894. PMID 8156635. S2CID 479549. doi:10.1161/01.RES.74.5.882.
- ^ Konings, K. T.; Kirchhof, C. J.; Smeets, J. R.; Wellens, H. J.; Penn, O. C.; Allessie, M. A. (1994). „High-density mapping of electrically induced atrial fibrillation in humans” (PDF). Circulation. 89 (4): 1665—80. PMID 8149534. S2CID 8723663. doi:10.1161/01.CIR.89.4.1665.
- ^ Verheule, S.; Wilson, E.; Everett t, 4th; Shanbhag, S.; Golden, C.; Olgin, J. (2003). „Alterations in atrial electrophysiology and tissue structure in a canine model of chronic atrial dilatation due to mitral regurgitation”. Circulation. 107 (20): 2615—22. PMC 1995672
 . PMID 12732604. doi:10.1161/01.CIR.0000066915.15187.51..
. PMID 12732604. doi:10.1161/01.CIR.0000066915.15187.51..
- ^ Sanders, Prashanthan; Morton, Joseph B.; Davidson, Neil C.; Spence, Steven J.; Vohra, Jitendra K.; Sparks, Paul B.; Kalman, Jonathan M. (2003). „Electrical Remodeling of the Atria in Congestive Heart Failure”. Circulation. 108 (12): 1461—8. PMID 12952837. S2CID 98443. doi:10.1161/01.CIR.0000090688.49283.67..
- ^ a b Gregory Y.H. Lip, MD Implications of the CHA2DS2-VASc and HAS-BLED Scores for Thromboprophylaxis in Atrial Fibrillation, VOLUME 124, ISSUE 2, P111-114, Published:September 30, 2010
- ^ Crijns, H. J.; Tjeerdsma, G.; De Kam, P. J.; Boomsma, F.; Van Gelder, I. C.; Van Den Berg, M. P.; Van Veldhuisen, D. J. (2000). „Prognostic value of the presence and development of atrial fibrillation in patients with advanced chronic heart failure”. European Heart Journal. 21 (15): 1238—45. PMID 10924313. doi:10.1053/euhj.1999.2107..
- ^ a b Wolf PA, Abbott RD, Kannel WB (1991). „Atrial fibrillation as an independent risk factor for stroke: the Framingham Study”. Stroke. 22 (8): 983—8. PMID 1866765. S2CID 498613. doi:10.1161/01.STR.22.8.983.
- ^ Hart, R. G.; Halperin, J. L. (1999). „Atrial fibrillation and thromboembolism: A decade of progress in stroke prevention”. Ann Intern Med. 131 (9): 688—95. PMID 10577332. S2CID 24225859. doi:10.7326/0003-4819-131-9-199911020-00010.
- ^ Wolf PA, Dawber TR, Thomas HE Jr; et al. (1978). „Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: the Framingham study.”. Neurology. 28 (10): 973—7. PMID 570666. S2CID 32831864. doi:10.1212/WNL.28.10.973.. Abstract/FREE Full Text
- ^ Krahn, Andrew D.; Manfreda, Jure; Tate, Robert B.; Mathewson, Francis A.L.; Cuddy, T. Edward (1995). „The natural history of atrial fibrillation: Incidence, risk factors, and prognosis in the manitoba follow-up study”. Am J Med. 98 (5): 476—84. PMID 7733127. doi:10.1016/S0002-9343(99)80348-9.
Spoljašnje veze[uredi | uredi izvor]
| Klasifikacija | |
|---|---|
| Spoljašnji resursi |
 | Molimo Vas, obratite pažnju na važno upozorenje u vezi sa temama iz oblasti medicine (zdravlja). |
