Интратекална инјекција

Интратекална инјекција (ИТИ) је примена неколико лекова инјекцијом кроз тврду мождану овојницу (интратекалним путе) у субарахноидни простор. Главна примена ИТИ је у анестезији и терапији бола. Овај пут има предност у томе што заобилази крвно-мождану баријеру и омогућава лековима са лошим продирањем да доспу у централни нервни систем. Тиме се успоставља ефикасан терапијск приступ пацијентима са хроничним немалигним или малигним болом и тешком спастичношћу, што омогућава убризганом леку да утичу на безбројне болести повезаних са патологијом кичме.
Однос ризика и користи од ИТИ чини овај поступак корисним интервентним приступом. Иако није без ризика, овај приступ има значајну терапијску маргину безбедности када се користи уз лекове са потврђеним безбедносним профилом и стране за ту врсту терапије специјализованих практичара.
Историја
[уреди | уреди извор]Прва перфорација субарахноидалног простора лумбалном пункцијом направљена је 1885. године ради примене кокаина за анестезију.[1]
Интратекално увођење контрастног материјала за мијелографију први пут је 1921. године извео Athanase Sicard, париски неуролог,[1] који је пре тога убризгавао липиодол у лумбалне мишиће за лечење болова у леђима и ишијаса. Sicard је добро познавао је радиопрозирну природу липиодола, и када га је један од његових помоћника случајно убризгао у кичмени субарахноидални простор без икаквих штетних ефеката, приметио је кретање контрастног средства на рендгенским снимцима. Тако је мијелографија уведена у клиничку праксу.
Међутим у почетку примене спиналне и епидуралне инјекције јављале су се честе неуролошке повреде, у распону од пролазне радикулопатије до параплегије (рани извештаји о неуролошким компликацијама укључују окуломоторну парализу, синдром кауда екуина и параплегију).[1][2]
Прва имплантабилна пумпа за интратекално и интравентрикуларно убризгавање морфијума за лечење бола од рака описана је 1978. године.[1][3]
Иако је најчешћа употреба интратекалног пута била она за давање анестетика, временом је почело све чешће убризгавање терапијских супстанци у интратекални простор кичмене мождине.
Савремена екстракранијална неураксијална анатомија
[уреди | уреди извор]| Субарахноидни простор | |
|---|---|
 Дијаграмски приказ пресека преко врха лобање, који приказује мембране мозга, итд. („Субарахноидна шупљина“ видљива лево.) | |
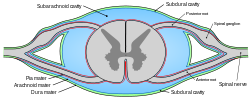 Дијаграмски попречни пресек медуле спиналис и њених мембрана. (Субарахноидална шупљина обојена плавом бојом.) | |
| Детаљи | |
| Идентификатори | |
| Латински | Spatium subarachnoideum, cavum subarachnoideale |
| Анатомска терминологија | |
Дурална врећа је кључна структура за дистрибуцију инфузионих лекова на субарахноидном нивоу. Спинална дурална врећа, унутар које се налази цереброспинална течност, састоји се од спољашњег слоја дуре и блиско прилепљеног унутрашњег арахноидног слоја, формирајући спољну баријеру субарахноидалног простора кичме (ССАС). Спиналне ивице спољне баријере субарахноидалног простора кичме формирају пију, која је сама по себи интимно повезана са површином кичменог паренхима и окружује мождину у свим аспектима. Унутрашњост пије матер пронађена је глија лимитанс а изван глије и неурони. Пијални слој кичмене мождане и овојнице представљају главну баријеру која регулише трансфер лекова између ликвора и кичмене мождине.[4][5][6]
Структурна сложеност спољне баријере субарахноидалног простора кичме обухвата:[1]
- трабекуларну везу између арахноидне и јајне материје,
- субарахноидних лигамената који периодично причвршћују простор на дисконтинуални начин дуж уздужне осе,
- нервне коренове који излазе из дорзалних и вентралних рогова.
Добре и лоше стране ИТИ
[уреди | уреди извор]Добре стране
[уреди | уреди извор]- Интратекални пут примене лека који је добро успостављен у анестезији и збрињавању бола.
- Он обезбеђује пут за транспорт лека дубоко у мозак преко ЦСФ.
- Вођени специфичном кинетиком продирања лека у ткиво, може се одредити брзина дисперзије лека, што могућава примену интратекалне терапије која је персонализована према потребама пацијента.
- Овај пут омогућава да се лекови са великим молекулима, као што су антисенс олигонуклеотиди, испоруче у ЦНС заобилазећи крвно-мождану баријеру, нпр. нусинерсен за спиналну мишићну атрофију.
- Системски нежељени ефекти неколико лекова (ао што су опиоиди) могу се избећи ако се лекови дају у мањим дозама за локализовано деловање у нервном систему.
Лоше стране
[уреди | уреди извор]- Нежељени ефекат интратекалне терапије је асептични или хемијски менингитис изазван лековима услед директне иритације мождане овојнице леком.
- Евентуално фатални изненадни квар на системима за ИТИ (интратекалне пумпе)
Индикације
[уреди | уреди извор]Убризгавање терапијских средстава у кичмену мождину може се вршити из три разлога.
Терапеутски циљеви
[уреди | уреди извор]Терапеутски циљеви ИТИ су повезани са следећим системима кичме:
- ганглијске ћелије дорзалног корена,
- нервни корени,
- дорзални или вентрални рог
- интратекални простор (менинге).
Интратекална примена аналгетика
Многа стања бола и измењене моторичке функције представљају промене у нормалној функцији кичме изазване повредом периферног ткива и нерва или променама које су последица трауме кичме (пресек, исхемија или компресија) или неуродегенеративних процеса (амиотрофична латерална склероза, соматомоторна атрофија).
Интратекална хемотерапија
Код патолошки процеси, као што су рак (менингеална карциноматоза, хордом) интратектални путем могу се убризгавати хемотерапутици[7][8][9][10]
Интратекална терапија бактеријских и гљивичних инфекција
Бактеријска или гљивична инфекција (менингитис) која захвата интратекални простор и његов садржај може се лечити ИТИ антибиотицима или фунгицидима (amphotericin B).
Интратекална терапија спастичне церебрална парализе
Примена баклофен користи се за спастичну церебралну парализу, применом преко интратекалне пумпе имплантиране непосредно испод коже абдомена (или иза зида грудног коша и повезане са цевчицом (катетером) директно са базом кичме, где купа кичмену мождину користећи дозу око хиљаду пута мању од оне коју захтева орално примењен баклофен. Интратекални баклофен такође не носи ниједан од нежељених ефеката, као што је поспаност, који се обично јављају код оралне примене баклофена. Међутим, интратекалне баклофен пумпе носе озбиљне клиничке ризике, као што су инфекција или евентуално фатални изненадни квар, а орални баклофен не.[11]
Спинална испорука лека
[уреди | уреди извор]Спинална испорука терапеутика може бити потребна јер терапеутска платформа нема системски приступ кичменом простору. Такви примери би били велики молекули (као што су зиконотид и фактори раста), антитела, платформе за вирусну трансфекцију које испоручују сиРНА/схРНА или олигонуклеотиде, који имају ограничен приступ ЦНС због ефикасне функције крвно-мождане баријере.
Већа ефикасност и мањи системски ризик
[уреди | уреди извор]Терапеутски агенс може бити ефикасан након системске испоруке, али испорука агенса директно у кичмени канал дозвољава:
- смањење системске изложености лековима,
- високе циљне концентрације са мање ефеката на периферне и не-кичмене системе.
Такви услови могу послужити за оптимизацију терапијских резултата смањењем профила нежељених ефеката, као што су опијати или баклофен; иако су системски ефикасни у својој интратекалној примени за лечење бола и спастичности, смањују системску изложеност, уз смањење секундарних ефеката и побољшање исхода.
Важно је да је значајан напредак у нашем разумевању неураксијалне биологије открио безброј нових циљева у дорзалном рогу и ганглијама дорзалног корена који регулишу ноцицептивну обраду. Посебно је узбудљиво развијање имплементације неураксијалним путем нових терапијских платформи, као што су токсини и циљање гена да би се спречила ноцицептивна обрада интратекалним испоруком. Овај фокус је резултирао повећаним интересовањем за динамику флуида екстракранијалног неураксијалног простора и приступима да се поузданије усмере захтеви дистрибуције различитих патологија. Стога, неке индикације могу захтевати ограничене сегментне ефекте (као код различитих индикација бола или спастичности), док друге могу захтевати ширу дистрибуцију (као код карцинома менингеа или неуродегенеративних поремећаја). Овде је употреба протокола за инфузију специфичних за пацијента постала тачка интересовања, и видимо промене у профилима испоруке пумпе (програмирању), конструкцији катетера и конфигурацијама које омогућавају ширу дистрибуцију малих количина инфузије равномерно дуж обима неураксиса и смањити ризик од локалних патологија зависних од концентрације које могу настати услед ограничене редистрибуције инфузата, што се може јавити са неураксијалном инфузијом мале запремине у простор са релативно малим протоком.
Извори
[уреди | уреди извор]- ^ а б в г д „Intrathecal administration of drugs”. MedLink Neurology (на језику: енглески). Приступљено 2024-02-06.[мртва веза]
- ^ Lusk, W. C. (1911). „II. The Anatomy of Spinal Puncture with Some Considerations on Technic and Paralytic Sequels”. Annals of Surgery. 54 (4): 449—484. ISSN 0003-4932. PMC 1406298
 . PMID 17862743. doi:10.1097/00000658-191110000-00002.
. PMID 17862743. doi:10.1097/00000658-191110000-00002.
- ^ Lazorthes, Y.; Sallerin-Caute, B.; Verdie, J. C.; Bastide, R. (1991). „Advances in drug delivery systems and applications in neurosurgery”. Advances and Technical Standards in Neurosurgery. 18: 143—192. ISSN 0095-4829. PMID 1930373. doi:10.1007/978-3-7091-6697-0_5.
- ^ Reina MA, Boezaart A, De Andres-Serrano C, Rubio-Haro R, De Andrés J. „Microanatomy relevant to intrathecal drug delivery”. Methods Mol Biol. 2059: 109—20. 2020. doi:10.1007/978-1-4939-9798-5_4..
- ^ Reina, Miguel Angel; Maches, Fabiola; López, Andrés; De Andrés, José Antonio (2008). „The ultrastructure of the spinal arachnoid in humans and its impact on spinal anesthesia, cauda equina syndrome and transient neurological syndrome”. Tech Reg Anesth Pain Management. 12 (3): 153—60. doi:10.1053/j.trap.2008.03.002.
- ^ Reina, M.A.; Prats-Galino, A.; Sola, R.G.; Puigdellívol-Sánchez, A.; Arriazu Navarro, R.; De Andrés, J.A. (2010). „Morfología de la lámina aracnoidea espinal humana. Barrera que limita la permeabilidad del saco dural”. Rev Esp Anestesiol Reanim. 57 (8): 486—92. doi:10.1016/S0034-9356(10)70709-X.
- ^ Grossman SA, Finklestein DM, Ruckdeschel JC, et al. (март 1993). „Randomized prospective comparison of intraventricular methotrexate and thiotepa with previously untreated neoplastic meningitis. Eastern Cooperative Oncology Group.”. Journal of Clinical Oncology. 11 (3): 561—9. PMID 8445432. doi:10.1200/jco.1993.11.3.561.
- ^ Schulmeister L (септембар 2004). „Preventing vincristine sulfate medication errors”. Oncology Nursing Forum. 31 (5): E90—8. PMID 15378106. doi:10.1188/04.ONF.E90-E98
 .
.
- ^ Qweider M, Gilsbach JM, Rohde V (март 2007). „Inadvertent intrathecal vincristine administration: a neurosurgical emergency. Case report”. Journal of Neurosurgery. Spine. 6 (3): 280—3. PMID 17355029. doi:10.3171/spi.2007.6.3.280.
- ^ International Medication Safety Network (2019), IMSN Global Targeted Medication Safety Best Practices, Приступљено 2020-03-11.
- ^ Cristina Midões, Ana (2016-05-15). „Functional outcome of continuous intrathecal baclofen pump infusion in spasticity”. dx.doi.org. Приступљено 2024-02-06.
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
