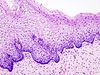
Цервикална интраепителна неоплазија
| Цервикална интраепителна неоплазија | |
|---|---|
 | |
| Класификација и спољашњи ресурси | |
| Специјалност | Гинекологија |
| МКБ-10 | D06, N87 |
| МКБ-9-CM | 233.1, 622.10 |
| MedlinePlus | 001491 |
| MeSH | D018290 |
Цервикална интраепителна неоплазија (CIN), цервикална дисплазија, цервикална интерстицијална неоплазија је преинвазивна промена на грлићу материце за коју се данас зна да, иако се не лечи, у већини случајева се спонтано повлачи. Међутим ова промене се током одређеног времена у овој промени се може развити у инвазивни карцином или рак грлића материце.[1][2]
Анатомија
[уреди | уреди извор]Врат материце (лат. cervix uteri) је њен доњи, цилиндрични део који се наставља на труп материце (лат. corpus uteri). Спољна страна цервикса (лат. exocervix), која штрчи у лумен вагине, као и сама материца обложена је вишеслојним плочастим епителом, док је унутрашња страна цервикса (лат. endocervix) обложена једнослојним цилиндричним епителом.[3]
Место, у којем вишеслојни плочасти епител егзоцервикса прелази у једнослојни цилиндрични епител ендоцервикса, носи назива сквамоколумнарна граница (СКГ). У зависности од тренутног хормонског статуса и животне доби, положај сквамоколумнарне границе се мења.[1] У хормонски неактивним периодима (детињство и постменопауза) СКГ налази се дубље у цервикалном каналу, док је у хормонски активним периодима (новорођеначки период живота, пубертет, генеративни период живота, трудноћа и код жена које узимају оралне хормонске контрацептиве) СКГ померена ниже, ван цервикалног канала.[1] Када је сквамоколумнарна граница померена ниже, једнослојни цилиндрични епител који је осетљивији, на утицај ниског пХ у вагини замењује се отпорнијим, метапластичне плочастим епителом. Зато се на егзоцервиксу могу уочити две сквамоколумнарне границе и зона преображаја:
- Прва која је оригинална или примарна СКГ у којој једнослојни цилиндрични епител прелази у оригинални вишеслојни плочасти епител пре процеса метаплазије,
- Друга или секундарна СКГ која је активна, и у којој једнослојни цилиндрични епител прелази у метаплазијом промењени плочасти епител.
- Зона преображаја је подручје између примарне и секундарне сквамоколумнарна границе (или трансформатциона зона)).
Како је незрели метапластичне плочасти епител осетљив на деловање разних онкогених фактора цервикална интраепителна неоплазија (CIN) у највећем броју случајева почиње као жариште у зони преображаја.

Етиологија
[уреди | уреди извор]Цервикална интраепителна неоплазија је примарна болест полно активних жена, а збога фактора ризика, сматра се и полно преносивом болешћу, за чији развој најзначајнију улогу има хумани папилома вирус (ХПВ).
Фактори ризика
[уреди | уреди извор]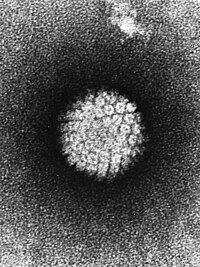
Као могући фактори ризика повезани са развојем цервикалне интраепителне неоплазије наводе се:
- Рани почетак полне активности,
- Чешће мењање полних партнера,
- Инфекција хуманим папилома вирусом (ХПВ) високог ризика,
- Полно преносиве болести (нпр херпес, хламидије),
- Бројне трудноће и већи број порођаја,
- Употреба оралних контрацептива,
- Пушење цигарета.[4]
Иако се већина полно активних жена барем једном током живота зарази ХПВ-ом, та инфекција обично није трајна и у већине жена долази до спонтаног нестајања вируса без развоја болести.[5][6] Међутим у мање од 10% жена које се заразе ХПВ-ом, развиће се трајна инфекција која може прогредирати у теже облике цервикалне интраепителне неоплазије.[7][8] До сада је откривено више од 200 подтипова ХПВ који се у више од 95% случајева манифестује као преинвазивних и инвазивних карцинома цервикса[7][9] Хумани папилома вирус групише се у ХПВ високог и ниског ризика, у зависности од њиховог онкогена потенцијала.
- ХПВ високог онкогеног ризика
У ову групу ХПВ спадају: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, и 68. Они могу узроковати интраепителне промене високог степена или карцином цервикса. ХПВ тип 16 и 18 су најчешће изоловани ХПВ типови, који узрокују више од 71% инвазивних карцинома. Међутим ХПВ тип 16 није специфичан јер се може наћи и у жена са CIN I и те код жена са уредним Папаниколу тестом.[7]
- ХПВ ниског онкогеног ризика
У ову групу ХПВ спадају: 6, 11, 41, 42, 43 и 44. Они су најчешће повезани са бенигним променама као што су кондиломи који ретко малигно алтерира.[7].[10][11]
Макроскопске промене у цервикалној интраепителној неоплазији
[уреди | уреди извор]Макроскопски, промене у цервикалној интраепителној неоплазији (CIN) су неспецифичне и могу се манифестовати као леукоплакија, ерозија цервикса, цервицитис или нема никаквих приметних промена. Хистолошки се унутар епитела налазе атипичне ћелије са хиперхромазијом језгара и митозе у површинским слојевима епитела, али без знакова инвазије у строму.[12]
Бројним истраживањима потврђено да је цервикална интраепителна неоплазије преканцероза и да у одређеном проценту жена он прелази у инвазивни карцином. Главна разлика између карцинома ин ситу и инвазивног карцинома је та што је код карцинома ин ситу танка базална мембрана, која дели епител од субепителног везивног ткива у којем се налазе крвни и лимфни судове, још увек интактна, док код инвазивног карцинома долази до продора малигних ћелија кроз базалну мембрану.[13][14]
Дијагноза
[уреди | уреди извор]Основни критеријум за дијагнозу интраепителне неоплазије су:
- Неједнакост у облику и величини ћелија и једара,
- Поремећај сазревања,
- Поремећај односа цитоплазма - једро
- Присутност митоза.
С обзиром на дебљину захватања вишеслојног плочастог епитела неопластичким процесом, разликују се три степена цервикалне интраепителне неоплазије (CIN).[4]
- CIN I
Промене код овог типа су најблажи облик цервикалне интраепителне неоплазије. Мерећи од базалне мембране, промене на ћелијама не захватају више од 1/3 дебљине епитела. У базалноме слоју налази се мали број митоза, а атипичне ћелије са атипичним једрима су ретке.
- CIN II
Овај облик неоплазије је средње тешки поремећај у коме су промене на ћелијама нешто израженије и присутне су у доње 2/3 епитела слузокоже мерећи од базалне мембране. Такође постоји поремећај у распореду и сазревању ћелија, уз видљиву присутност незрелих ћелија са повећаним садржајем хроматина. Слој базалних ћелија је проширен и садржава већи број митоза и већи број ћелија атипичног изгледа.
- CIN III
Ово је најтежи облик дисплазије и карцином ин ситу. У ово стадијуму диспластичне ћелије налазе се у више од 2/3 дебљине епитела или је захваћена цела дебљина епитела. Присутне су многобројне митозе и бројне ћелије са изразитим променама на једрима. Знаци сазревања и диференцијације епитела налазе се само у горњој трећини епитела.
Упоредни систем класификације премалигних промена грлића материце
| Дисплазија Карцином ин ситу |
CIN Цервикалнаинтраепителна неоплазија |
SIL Сквамознаинтраепителна лезија |
Последице | Хистолошки налаз |
|---|---|---|---|---|
| Нормални изглед сквамозног епитела грлића (цервикса) материце |
||||
| Дисплазија лаког степена | L-SIL (Low-grade SIL/SIL ниског степена) | |||
| Дисплазија средњег степена | H-SIL (High-grade SIL/SIL високог степена) | Претходи већини инвазивних форми планоцелуларног карцинома |
||
| Дисплазија тешког степена | H-SIL (High-grade SIL/SIL високог степена) | Претходи већини инвазивних форми планоцелуларног карцинома |
Дијагноза се поставља на основу:
Терапија
[уреди | уреди извор]
У терапији цервикалне интраепителне неоплазија (ЦИН) углавном се користе хируршке методе, у облику локално деструктивних или ексцизијских метода, које се примењују у амбулантним или болничким условима. Примарни циљ лечења је да се у потпуности одстране и униште ћелије атипичног епитела.
Хируршка терапија
[уреди | уреди извор]| Аблативне технике - методе | Ексцизионе технике - методе |
|---|---|
|
|
- Локалне деструктивне (аблативне) методе
Од локално деструктивних метода најчешће се користе: криотерапија, ласерска вапоризација, радикална дијатермија и хладна коагулација. Иако се локално деструктивне методе боље подносе и имају мање компликација, њихов главни недостатак у односу на ексцизијске методе је немогућност узимања узорка ткива за патохистолошку анализу.[1]
Локално деструктивне методе могу се користити ако је колпоскопија задовољавајућа, тј. ако се у потпуности прикаже зона трансформације, ако не постоји сумња на микроинвазивну или инвазивну болест, као и ако не постоји сумња на жљездану болест.
- Ексцизионе методе
Ексцизионе методе су обавезне уколико се колпоскопски не може у целости приказати зона трансформације или уколико постоји сумња на инвазивну и жлездану болест. Од ексцизијских метода данас се најчешће користе ласерска конизација и LLETZ (енгл. large loop excision of the transformation zone).
Индикације за ексцизионе методе су:
- Ако лезија захвата ендоцервикалне канал
- Уколико постоје велике, комплексне лезије
- Код незадовољавајућег налаза (сквамоколумнарна граница није доступна прегледу)
- Ако не постоји корелација између цитологије и колпоскопије
- У случају рекурентне болести
Ласерска конизација се најчешће изводи у локалној анестезији уз помоћ ласерских зрака који истовремено режу и коагулишу тако да је након интервенције крварење минимално. Главни недостатак ове методе је могуће термичко оштећење ткива због чега би била немогућа анализа ивица промене.
Данас се све чешће у клиничкој пракси користи најпоштеднији (најмање инвазивни) дијагностичко-терапијски захват LLETZ који се изводи у локалној анестезији. Ова метода користи електродијатермијску петљу која истовремено реже и коагулише ткиво, и зато даје одличну хемостазу. За разлику од ласерске конизације, термичка оштећења су минимална и не утичу значајно на патохистолошку анализу ивица промене.[15]
- Постинтервенционо праћење болеснице
Независно од ризика за резидуалну или рекурентну интраепителну болест, све жене које су лечене због CIN-a имају пет пута већи ризик за настатанк инвазивног карцинома него општа популација и то независно од методе којом је рађена интервенција.[16] Због тога је обавезно праћење свих жена, најмање 10 године после третмана. У прве две године он се спроводи сваких шест месеци а након тога једном годишње. У случају атипије налаза обавезна је патохистолошка дијагностика
Види још
[уреди | уреди извор]Извори
[уреди | уреди извор]- ^ а б в г Šimunić V. Ginekologija. 2. izd. Zagreb: Naklada Ljevak; 2001.
- ^ Vitković L, Mijović M, Trajković G, Jakovljević S. Histološko-citološka korelacija nalaza ipouzdanost papanicolau testa u otkrivanju premalignih i malignih promena na grlićumaternice. Praxis Medica. 2015;44:23–31.
- ^ Junquiera LC. Osnove histologije. 10. izd. Zagreb: Školska knjiga; 2005.
- ^ а б Damjanov I, Jukić S, Nola M. Patologija. 3.izd. Zagreb: Medicinska naklada; 2011.
- ^ Stanley M. Pathology and epidemiology of HPV infection in females. Gynecol Oncol.2010;117:5-10
- ^ Moscicki AB. Impact of HPV infection in adolescent populations. J Adoles Health. 2005;37:3-9
- ^ а б в г Choi YJ, Park JS. Clinical significance of human papilloma virus genotyping. J GynecolOncol. 2016;27:e21.
- ^ Parkin DM, Bray F. The burden of HPV-related cancers. Vaccine. 2006;24:11–25.
- ^ Martin-Hirsch PPL, Paraskevaidis E, Bryant A, Dickinson HO. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2010;16:CD001318
- ^ Park IU, Wojtal N, Silverberg MJ, Bauer HM, Hurley LB, Manos M. Cytology and HumanPapillomavirus Co-Test Results Preceding Incident High-Grade Cervical IntraepithelialNeoplasia. PLoS One. 2015;880:1–10.
- ^ de Sanjose S, Quint WG, Alemany L. Human papillomavirus genotype attribution ininvasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol2010;11:1048-56.
- ^ Popović-Lazić J. Histološka slika cervikalnih intraepitelnih neoplazija. Dijagnostika i lečenje oboljenja cerviksa, vagine i vulve. Kolposkopski atlas. Elit-Medica. 2006;23-6.
- ^ Grade N, Cortecchia S, Galanti G, Sgadari C, Costa S, Lillo M. Follow-up study of patientswith cervical intraepithelial neoplasia grade 1 overexpressing p16Ink4a. Int J GynecolCancer. 2013;23:1663–9.
- ^ Vrdoljak-Mozetič D. Papa test danas - nova, Bethesda klasifikacija. Medix. 2005;11:85-9
- ^ Martin-Hirsch PPL, Paraskevaidis E, Bryant A, Dickinson HO. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2010;16:CD001318.
- ^ W.P Soutter, A de Barros Lopes, A Fletcher et al. Invasive cervical cancer after conservative therapy for cervical intraepithelial neoplasia. Lancet, 1997; 349:978– 980
Спољашње везе
[уреди | уреди извор]
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |