Fosfat — разлика између измена
мНема описа измене |
м Разне исправке |
||
| Ред 1: | Ред 1: | ||
[[ |
[[Слика:Phosphate_formula.svg|мини|upright|Generalna hemijska struktura organofosfata.]] |
||
[[ |
[[Слика:Phosphate Group.PNG|upright|мини|[[Strukturna formula]] fosfatne [[funkcionalna grupa|funkcionalne grupe]] kao što se nalazi u slabo [[kiselina|kiselim]] [[vodeni rastvor|vodenim rastvorima]]. U [[baza (hemija)|baznim]] vodenim rastvorima, grupa donira dva [[atom]]a [[vodonik]]a i [[jon]]izovana je kao fosfatna grupa sa negativnim naelektrisanjem od 2.<ref>{{cite book |last = Campbell|first = Neil A.|coauthors = Reece, Jane B.|title = Biology|edition = Seventh|publisher = Benjamin Cummings|date = 2005|location = San Francisco, California|pages = 65|isbn = 0-8053-7171-0 }}</ref>]] |
||
'''Fosfat''', je [[neorganska hemija|neorganskoj hemiji]] [[so|so]] [[fosforna kiselina|fosforne kiseline]]. U [[organska hemija|organskoj hemiji]], fosfat, ili [[organofosfat]], je [[estar]] fosforne kiseline. Organski fosfati su važni u [[biohemija|biohemiji]] i [[biogeohemija|biogeohemiji]] ili [[ekologija|ekologiji]]. Neorganiski fosfati se [[rudarstvo|iskopavaju]] da bi se dobio [[fosfor]] za upotrebu u agrikulturi i industriji.<ref name=PhosphatePrimer>{{ cite web |url=http://fipr1.state.fl.us/PhosphatePrimer |title=Phosphate Primer}}</ref><ref name=Kuntz1>{{ cite web |url=http://www.foodproductdesign.com/articles/661ingredient2.html |title=Figuring Out Phosphates |month=June |year=2006 |author=Lynn A. Kuntz }}</ref><ref name=Kuntz2>{{ cite web |url=http://www.foodproductdesign.com/articles/661ingredient2.html |month=June |year=2006 |author=Lynn A. Kuntz |title=Food Product Design }}</ref> Na povišenim temperaturama u čvrstom stanju, fosfati mogu da se [[Reakcija kondenzacije|kondenzuju]] i formiraju [[Pirofosfat|pirofosfate]]. |
'''Fosfat''', je [[neorganska hemija|neorganskoj hemiji]] [[so|so]] [[fosforna kiselina|fosforne kiseline]]. U [[organska hemija|organskoj hemiji]], fosfat, ili [[organofosfat]], je [[estar]] fosforne kiseline. Organski fosfati su važni u [[biohemija|biohemiji]] i [[biogeohemija|biogeohemiji]] ili [[ekologija|ekologiji]]. Neorganiski fosfati se [[rudarstvo|iskopavaju]] da bi se dobio [[fosfor]] za upotrebu u agrikulturi i industriji.<ref name=PhosphatePrimer>{{ cite web |url=http://fipr1.state.fl.us/PhosphatePrimer |title=Phosphate Primer}}</ref><ref name=Kuntz1>{{ cite web |url=http://www.foodproductdesign.com/articles/661ingredient2.html |title=Figuring Out Phosphates |month=June |year=2006 |author=Lynn A. Kuntz }}</ref><ref name=Kuntz2>{{ cite web |url=http://www.foodproductdesign.com/articles/661ingredient2.html |month=June |year=2006 |author=Lynn A. Kuntz |title=Food Product Design }}</ref> Na povišenim temperaturama u čvrstom stanju, fosfati mogu da se [[Reakcija kondenzacije|kondenzuju]] i formiraju [[Pirofosfat|pirofosfate]]. |
||
| Ред 13: | Ред 13: | ||
<gallery widths=100px heights=80px> |
<gallery widths=100px heights=80px> |
||
Слика:3-phosphoric-acid-3D-balls.png|<center>-{H<sub>3</sub>PO<sub>4</sub>}-</center> |
|||
Слика:2-dihydrogenphosphate-3D-balls.png|<center>-{H<sub>2</sub>PO<sub>4</sub><sup>−</sup>}-</center> |
|||
Слика:1-hydrogenphosphate-3D-balls.png|<center>-{HPO<sub>4</sub><sup>2−</sup>}-</center> |
|||
Слика:0-phosphate-3D-balls.png|<center>-{PO<sub>4</sub><sup>3−</sup>}-</center> |
|||
</gallery> |
</gallery> |
||
Верзија на датум 20. октобар 2010. у 11:59

Fosfat, je neorganskoj hemiji so fosforne kiseline. U organskoj hemiji, fosfat, ili organofosfat, je estar fosforne kiseline. Organski fosfati su važni u biohemiji i biogeohemiji ili ekologiji. Neorganiski fosfati se iskopavaju da bi se dobio fosfor za upotrebu u agrikulturi i industriji.[2][3][4] Na povišenim temperaturama u čvrstom stanju, fosfati mogu da se kondenzuju i formiraju pirofosfate.
Hemijske osobine
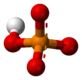
Fosfatni jon je poliatomski jon sa empirijskom formulom PO43− i molarnom masom od 94.973 g/mol. On se sastoji od jednog centralnog atoma fosfora atom okruženog sa četiri atoma kiseonika u tetraedarskoj konfiguraciji. Fosfatni jon nosi tri negativa formalna naelektrisanja i on je konjugovana baza hidrogen fosfatnog jona, HPO42-, koji je konjugovana baza H2PO4-, dihidrogen fosfatnog jona, koji je konjugovana baza H3PO4, fosforne kiseline. On je hipervalentni molekul (atom fosfora ima 10 elektrona u svojoj valentnoj ljuski). Fosfat je takođe organofosforno jedinjenje sa formulom OP(OR)3.
Fosfatne soli se formiraju kad se pozitivno-naelektrisani jon veže za negativno-naelektrisane atome kiseonika, formirajući jonsko jedinjenje. Mnogi fosfati nisu rastvorni u vodi na standardnoj temperaturi i pritisku. Natrijum, kalijum, rubidijum, cezijum i amonijum fosfati su rastvorni u vodi. Većina drugih fosfata su veoma malo rastvorni ili nerastvorni u vodi. Kao pravilo, hidrogen i dihidrogen fosfati su nešto rastvorniji od korespondirajućih fosfata. Pirofosfati su uglavnom rastvorni u vodi.
U razređenim vodenim rastvorima, fosfat postoji u četiri oblika. U jako-baznoj sredini, fosfatni jon (PO43−) predominira, dok u slabo-baznim uslovima, hidrogen fosfatni jon (HPO42−) je prevalentan. U slabo-kiselim uslovima, dihidrogen fosfatni jon (H2PO4−) je najzastupljeniji. U jako-kiseloj sredini, fosforna kiselina (H3PO4) je glavna forma.
-
H3PO4 -
H2PO4− -
HPO42− -
PO43−
Precizniji, polazeći od sledeće tri ravnotežne reakcije:
- H3PO4 ⇌ H+ + H2PO4−
- H2PO4− ⇌ H+ + HPO42−
- HPO42− ⇌ H+ + PO43−
korespondirajuće konstante disocijacije na 25°C (u mol/L) su:
- (pKa1 2.12)
- (pKa2 7.21)
- (pKa3 12.67)
Literatura
- ^ Campbell, Neil A. (2005). Biology (Seventh изд.). San Francisco, California: Benjamin Cummings. стр. 65. ISBN 0-8053-7171-0. Непознати параметар
|coauthors=игнорисан [|author=се препоручује] (помоћ) - ^ „Phosphate Primer”.
- ^ Lynn A. Kuntz (2006). „Figuring Out Phosphates”. Непознати параметар
|month=игнорисан (помоћ) - ^ Lynn A. Kuntz (2006). „Food Product Design”. Непознати параметар
|month=игнорисан (помоћ)




![{\displaystyle K_{a1}={\frac {[{\mbox{H}}^{+}][{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}{[{\mbox{H}}_{3}{\mbox{PO}}_{4}]}}\simeq 7.5\times 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e81fc5d22c187e5acc19c15b8422a604474b916)
![{\displaystyle K_{a2}={\frac {[{\mbox{H}}^{+}][{\mbox{HPO}}_{4}^{2-}]}{[{\mbox{H}}_{2}{\mbox{PO}}_{4}^{-}]}}\simeq 6.2\times 10^{-8}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c10e3502ce38d504ebf659f7411f2d2f24015c25)
![{\displaystyle K_{a3}={\frac {[{\mbox{H}}^{+}][{\mbox{PO}}_{4}^{3-}]}{[{\mbox{HPO}}_{4}^{2-}]}}\simeq 2.14\times 10^{-13}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/42097ca31fd0468791802af675f407bda4e4c871)