Натријум
 три комада сивог елемента | |||||||||||||||||||||
| Општа својства | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | натријум, Na | ||||||||||||||||||||
| Изглед | сребрнастобео, металан | ||||||||||||||||||||
| У периодном систему | |||||||||||||||||||||
| |||||||||||||||||||||
| Атомски број (Z) | 11 | ||||||||||||||||||||
| Група, периода | група 1 (алкални метали), периода 3 | ||||||||||||||||||||
| Блок | s-блок | ||||||||||||||||||||
| Категорија | алкални метал | ||||||||||||||||||||
| Рел. ат. маса (Ar) | 22,98976928(2)[1] | ||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||
по љускама | 2, 8, 1 | ||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||
| Тачка топљења | 370,944 K (97,794 °C, 208,029 °F) | ||||||||||||||||||||
| Тачка кључања | 1156,090 K (882,940 °C, 1621,292 °F) | ||||||||||||||||||||
| Густина при с.т. | 0,968 g/cm3 | ||||||||||||||||||||
| течно ст., на т.т. | 0,927 g/cm3 | ||||||||||||||||||||
| Критична тачка | 2573 K, 35 MPa (екстраполисано) | ||||||||||||||||||||
| Топлота фузије | 2,60 kJ/mol | ||||||||||||||||||||
| Топлота испаравања | 97,42 kJ/mol | ||||||||||||||||||||
| Мол. топл. капацитет | 28,230 J/(mol·K) | ||||||||||||||||||||
Напон паре
| |||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||
| Електронегативност | 0.93 | ||||||||||||||||||||
| Енергије јонизације | 1: 495,8 kJ/mol 2: 4562 kJ/mol 3: 6910,3 kJ/mol (остале) | ||||||||||||||||||||
| Атомски радијус | 186 pm | ||||||||||||||||||||
| Ковалентни радијус | 166±9 pm | ||||||||||||||||||||
| Валсов радијус | 227 pm | ||||||||||||||||||||
| Остало | |||||||||||||||||||||
| Кристална структура | унутрашњецентр. кубична (BCC) | ||||||||||||||||||||
| Брзина звука танак штап | 3200 m/s (на 20 °C) | ||||||||||||||||||||
| Топл. ширење | 71 µm/(m·K) (на 25 °C) | ||||||||||||||||||||
| Топл. водљивост | 142 W/(m·K) | ||||||||||||||||||||
| Електрична отпорност | 47,7 nΩ·m (на 20 °C) | ||||||||||||||||||||
| Магнетни распоред | парамагнетичан[2] | ||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | +16,0·10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||
| Јангов модул | 10 GPa | ||||||||||||||||||||
| Модул смицања | 3,3 GPa | ||||||||||||||||||||
| Модул стишљивости | 6,3 GPa | ||||||||||||||||||||
| Мосова тврдоћа | 0,5 | ||||||||||||||||||||
| Бринелова тврдоћа | 0,69 MPa | ||||||||||||||||||||
| CAS број | 7440-23-5 | ||||||||||||||||||||
| Историја | |||||||||||||||||||||
| Откриће и прва изолација | Хамфри Дејви (1807) | ||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||
| |||||||||||||||||||||
Натријум (Na, лат. natrium) елемент је IA групе са атомским бројем 11. Једини стабилни изотоп му је 23Na.[4] Натријум је мекан, сребрно-бео, веома реактиван метал.
Открио га је енглески хемичар сер Хамфри Дејви (енгл. Sir Humphry Davy) 1807. електролизом масне соде (NaOH). Елементарни натријум не постоји на Земљи зато што на ваздуху лако оксидира, а и бурно реагује са водом, тако да се мора чувати у не-оксидујућим срединама(течни угљоводоници).
Јон натријума је растворљив у води, те је присутан у океанима и свим деловима стагнирајуће воде углавном у облику NaCl (кухињска со) Натријум је елемент суштинске важности за животиње, људе и неке врсте биљака, а катјони натријума спадају међу најважније унутарћелијске катјоне, и неопходни су за одржање ћелијске мембране. Катјони Na+ делује у супротности са катјонима калијума К+ да би изградили електростатички набој на ћелијским мембранама и на тај начин пренели нервне импулсе. Катјони Na+ припадају V групи катјона и боје пламен у интензивно жуту боју.
Натријум је реактивнији од литијума, али је мање реактиван од калијума. Мали комад натријума ће са водом реаговати бурно: запалиће се и брзо ће се кретати по површини воде, а велики комад ће експлодирати.
Најважнија једињења натријума су: натријум-хлорид (NaCl), натријум-нитрат (чилска шалитра), натријум-карбонат, натријум-бикарбонат, ...
Историја[уреди | уреди извор]
Натријум је открио енглески хемичар Хамфри Дејви 1807. године електролизом растаљеног натријум-хидроксида (NaOH).
У старом Египту и у античким временима из сланих језера се добијала сода, коју су Египћани звали нетјерј (нетер). Грци су преузели ову реч као νίτρον nitron, Римљани као nitrium, а Арапи као ناترون natrun.[5] Једињења натријума су, за разлику од елементарног натријума, позната много дуже, а нека од њих су се добијали и прерађивали из морске воде, језера и извора земног плина. Једно од најважнијих једињења натријума је натријум хлорид (кухињска со), која се добија у рудницима или исушивањем морске воде односно сланих подземних вода. Током историје, кухињска со је била један од најважнијих трговачких артикала, на којем су многи историјски градови изградили своју војну и економску моћ. И данас називи бројних градова су изведени из речи со, као што је Тузла (тур. tuz) или Салцбург (нем. Salz), те Хале, Бад Хал или Хал у Тиролу по германском називу Hall.[6] Осим соли, и бројна друга природна натријумова једињења попут натријум карбоната (сода или натрон) су се такође користили од давних времена.

Добијање елементарног натријума први пут је успело енглеском научнику Хамфри Дејви у 1807. године путем електролизе истопљеног натријум хидроксида (живе соде) кориштењем Волтиног електростатичког стуба као извора струје. По извештају Краљевског друштва из Лондона од 19. новембра 1807. године, Дејви је добио два различита метала: у соди садржани натријум који је он назвао sodium, назив који се и данас користи за овај елемент у француском и енглеском језику, те други метал који је он назвао potassium (калијум). Берцелијус је 1811. године уместо sodium предложио данашњи назив натријум.[5]
Особине[уреди | уреди извор]
Физичке[уреди | уреди извор]
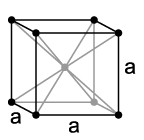
Натријум је сребрнасто бели, меки и лаки метал. У многим физичким особинама, натријум стоји између литијума и калијума. Тако на пример, тачка топљења натријум износи 97,82 °C, што је између литијумове (180,54 °C) и калијумове (63,6 °C).[8] Слично је и код тачке кључања и специфичног топлотног капацитета. Са густином од 0,968 g · cm−3[8] натријум спада у елементе са најмањом специфичном тежином. Међу елементима који су у чврстом стању на собној температури, само још литијум и калијум имају мању густину. На Моховој скали тврдине, натријум има вредност од 0,5[9], односно тако је мек да се може резати ножем.
Натријум се, као и други алкални метали, кристализује у кубном кристалном систему у кубној просторно центрираној решетки са просторном групом и две формулске јединице по једној елементарној ћелији. Испод температуре од 51 K он прелази у хексагоналну густу кугласту структуру са параметром решетке од a = 376 pm и c = 615 pm über.[7] Натријумoва пара се састоји из појединих атома метала, али и димера у облику Na2. На тачки кључања око 16%[8] атома се налази у облику димера. Пара натријума је жуте боје, а гледајући кроз њу назире се и љубичаста боја.
С калијумом гради течне смесе на собној температури у разним опсезима концентрација. Фазни дијаграм при 7 °C показује перитектична отопљена једињења Na2K и еутектичну тачку на −12,6 °C са садржином калијума од 77% по масеном уделу.[10]

Хемијске[уреди | уреди извор]
Као и други алкални метали, натријум је веома неплеменит елемент (електродни потенцијал: −2,71 V[8]) и врло лако реагује са бројним другим елементима, а једним делом и са једињењима. Он најлакше реагује са неметалима, попут хлора и сумпора, врло бурно, дајући понекад и интензивно жути пламен. Код посебно бурне реакције са кисеоником јавља се једна посебност. Натријум и кисеоник међусобно не реагирају без присуства воде на собној температури чак и при загревању. У атмосфери без присуства воде али уз присуство кисеоника, натријум се чак може и топити а да не реагује с кисеоником. Међутим, ако при томе дође у контакт са влагом, врло лако се запали те настаје натријум-пероксид[8]
- реакција натријума и кисеоника
Са водом натријум реагује тако што из воде истискује водоник те гради натријум-хидроксид. У алкохолима натријум гради натријум алкохолате, а из њих такође истискује водоник. Због велике реакционе топлоте, натријум се у реакцијама често топи. Ако се у реакцији појави натријум који је у праху, тако да се повећа реактивна површина натријума, може доћи и до експлозије, а водоник се може запалити. Уколико натријум дође у контакт са једињењима која у себи садрже хлор, као што су дихлорметан, хлороформ и тетрахлорметан, долази до стварања натријум-хлорида у брзој и егзотермној реакцији.
- реакција натријумa и воде

Натријум се отапа у течном амонијаку даје плаву боју. Боја се јавља због ослобођених електрона, које натријум отпушта у раствору. На тај начин, такав раствор проводи електричну струју и благо је парамагнетичан.
Изотопи[уреди | уреди извор]
Познато је укупно 15 изотопа и два нуклеарна изомера натријума почев од 18Na до 33Na.[11] Међутим, од њих само један изотоп 23Na се може наћи у природи. Стога је натријум један од 22 хемијска елемента који имају само један стабилан изотоп. Изотоп са најдужим временом полураспада је 22Na чије време полураспада износи 2,602 година[11] а распада се путем бета распада и прелази у 22Ne и 24Na који се користи у нуклеарној медицини као трејсер. Сви други изотопи и нуклеарни изомери имају врло кратка времена полураспада у интервалима од неколико секунди или милисекунди.
Распрострањеност[уреди | уреди извор]


У познатом свемиру, натријум је 14. хемијски елемент по заступљености,[12] што се приближно може упоредити са распрострањеношћу калцијума и никла. У емитованим светлосним линијама многих свемирских тела, међу њима и Сунца, могуће је детектовати и жуте Ђлиније натријума. На Земљи, натријум је садржан у Земљиној кори у приближном уделу од 2,36%,[13] што га ставља на шесто место најраспрострањенијих елемената на Земљи. Међутим, због своје велике реактивности, не појављује се у елементарном стању. Међу бројним једињењима највише су заступљене соли натријума. Један од највећих извора натријумових соли је морска вода. Један литар морске воде просечно садржи 11 грама јона натријума.[8]
Чести минерали натријума су албит, познат и као натронски фелдспат са формулом NaAlSi3O8 и олигоклас (Na,Ca)Al(Si,Al)3O8. Поред ових минерала који су саставни делови стена из групе фелдспата, натријум се такође налази и у облику великих наслага соли, нарочито обичне кухињске соли. Постоје огромне залихе натријум хлорида (минерала халита, познатог и као камена со). Поред ње, со се добија и исушивањем морске воде. Оне представљају најважнији извор натријума и његових осталих једињења. Један од познатих рудника камене соли на Балкану налази се у Тузли, а дуж обале Јадранског мора налазе се бројне солане. Камене соли има и у Немачкој, где су познати рудници у градовима Залцгитер, Бад Рајхенхал, Штаде и Бад Фридрихсхал. У облику минерала налази се и у облику алумосиликата NaAlSi3O8, чилеанске шалитре (NaNO3), халита (NaCl) и криолита Na3AlF6.
Поред натријум-хлорида, у природи се могу наћи и друге соли натријума. Тако на пример један од ретких природних натријумових минерала је и натријум нитрат или натронска шалитра (Чилеанска шалитра) NaNO3. Због своје добре растворљивости у води она се може наћи само у посебно сувим подручјима, као што је пустиња Атакама у Чилеу. Пре него што је откривен Хабер-Бошов процес, чилеанска шалитра је била основна сировина за производњу вештачких ђубрива и експлозива. Натријум карбонат Na2CO3 се такође може наћи у великим количинама у многим природним материјалима. Најпознатији такав минерал је сода Na2CO3 · 10 H2O. Она се копа у индустријским количинама а највећим делом се користи у производњи стакла. Осим ових, постоје бројни други минерали натријума. Један од познатијих је криолит (Na3[AlF6]), који у истопљеном стању служи, између осталог, као растварач за алуминијум оксид у процесу производње алуминијума. Данас је познато само једно место где се у природи може наћи криолит на Гренланду, тако да се криолит углавном прави вештачки.
Референце[уреди | уреди извор]
- ^ Meija, J.; et al. (2016). „Atomic weights of the elements 2013 (IUPAC Technical Report)”. Pure and Applied Chemistry. 88 (3): 265—291. doi:10.1515/pac-2015-0305.
- ^ Magnetic susceptibility of the elements and inorganic compounds Архивирано на сајту Wayback Machine (12. јануар 2012), in Lide, D. R., ур. (2005). CRC Handbook of Chemistry and Physics (86th изд.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. стр. E110. ISBN 0-8493-0464-4.
- ^ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3. изд.). Prentice Hall. ISBN 978-0-13-175553-6.
- ^ а б Mineralienatlas: Natrium
- ^ David Stifter: Hallstatt – In eisenzeitlicher Tradition? Архивирано на сајту Wayback Machine (21. фебруар 2014) (PDF;). u: Interpretierte Eisenzeiten. Fallstudien, Methoden, Theorie. Tagungsbeiträge der 1. Linzer Gespräche zur interpretativen Eisenzeitarchäologie. Hrsg. Raimund Karl, Jutta Leskovar (= Studien zur Kulturgeschichte von Oberösterreich 18), Linz: Oberösterreichisches Landesmuseum 2005, str. 229–240.
- ^ а б K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente. u: Acta Crystallographica, 1974, B30, str. 193–204; . doi:10.1107/S0567740874002469. Недостаје или је празан параметар
|title=(помоћ) - ^ а б в г д ђ Holleman-Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 изд.). Berlin. ISBN 978-3-11-017770-1.
- ^ natrij na webelements.com, fizičke osobine
- ^ van Rossen, G.L.C.M.; van Bleiswijk, H.: Über das Zustandsdiagramm der Kalium-Natriumlegierungen. u: Z. Anorg. Chem., 1912, 74, str. 152–156; . doi:10.1002/zaac.19120740115. Недостаје или је празан параметар
|title=(помоћ). - ^ а б G. Audi, O. Bersillon, J. Blachot, A. H. Wapstra: The Nubase evaluation of nuclear and decay properties Архивирано на сајту Wayback Machine (24. јул 2013) (PDF)
- ^ A. G. W. Cameron: Abundances of the elements in the solar system. u: Space Science Reviews, 1970, 15, str. 121–146; . doi:10.1007/BF00172440. Недостаје или је празан параметар
|title=(помоћ) - ^ K. H. Wedepohl: The composition of the continental crust. u: Geochimica et Cosmochimica Acta, 1995, 59, 7, str. 1217–1232; . doi:10.1016/0016-7037(95)00038-2. Недостаје или је празан параметар
|title=(помоћ)
Литература[уреди | уреди извор]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (II изд.). Oxford: Butterworth-Heinemann. ISBN 0080379419.





