Парцијални притисак
Парцијални притисак у смеши идеалних гасова у неком спремнику, је притисак који би гас имао када би сам заузимао исти спремник. Укупан притисак смеше гасова је збир појединих парцијалних притисака свих компоненти у смеши.[1]
Парцијални притисак гаса раствореног у течности је једнак парцијалном притисаку гаса, који би он створио у гасном облику, у равнотежи са течношћу, једнаке температуре. Парцијални притисак неког гаса је мера термодинамичке активности гасних молекула. Гасови ће увек ићи из подручја вишег парцијалног притисака у нижи, и што је већа разлика, то ће проток бити већи. Гасови које се мешају ће деловати према њиховим парцијалним притисцима.
Далтонов закон парцијалних притисака[уреди | уреди извор]
Далтонов закон говори о притисцима појединих врста гасова у смеши гасова, а гласи: притисак смеше једнак је збиру парцијалних притисака гасова који чине смешу. Парцијални притисак одређеног гаса у смеши, је онај притисак који би тај гас имао када би сам заузимао запремину, коју заузима смеша.[2]
На пример, ако имамо смешу идеалних гасова азота (Н2),водоника (Х2) и амонијака (НХ3):
| где је: | |
| - укупан притисак смеше гасова | |
| - парцијални притисак азота (Н2) | |
| - парцијални притисак водоника (Х2) | |
| - парцијални притисак амонијака (НХ3) |
Идеална смеша гасова[уреди | уреди извор]
У смеши идеалних гасова, парцијални притисци се односе као и број различитих молекула. Молни удео појединог гаса се може изразити као и њевов парцијални притисак:[3]
па се парцијални притисак поједине компоненте може изразити као:
| где је: | |
| - молни удео појединог гаса у смеши гасова | |
| - парцијални притисак појединог гаса у смеши гасова | |
| - број молова појединог гаса у смеши гасова | |
| - укупан број молова у смеши гасова | |
| - укупан притисак смеше гасова |
Притисак паре[уреди | уреди извор]
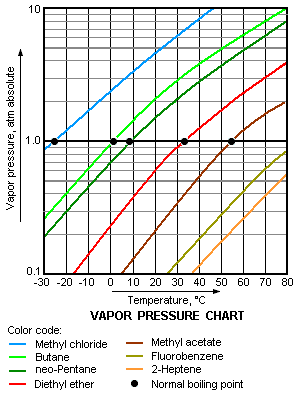
Притисак паре је парни притисак у равнотежи са осталим материјама које су у течном или чврстом стању. Овај појам се користи највише за описивање тежње течности да испарава. То је уствари мера тежње молекула или атома да побегну из течности или чврсте материје. Тачка кључања течности под атмосферским притиском одговара температури када је притисак паре једнак околном атмосферском притиску и често се назива нормално врелиште.[4]
Што је виши притисак паре течности на некој температури, то је нормално врелиште течности ниже. На пример, пропан има највиши притисак паре од свих гасова на дијаграму, а има и најниже нормално врелиште (-43,7 °Ц), а то се може видети из пресека линије пропана (љубичаста линија) са линијом која приказује притисак од 1 атм.
Парцијални притисци у гасова за роњење[уреди | уреди извор]
Код ронилачке опреме удео неког појединог гаса за роњење се изражава парцијалним притисцима. Парцијални притисак се може израчунати:
- парцијални притисак = укупан апсолутни притисак смеше x удео запремине поједине компоненте
За неки гас "и" вреди:
- ппи = П x Фи
На пример, на 50 метара дубине, апсолутни притисак је 6 бара (600 кПа) = 1 бар атмосферског притисака + 5 бара притиска воде, и парцијални притисци најважнијих компоненти ваздуха, кисеоник је 21% запремине и азот је 79% запремине, су:
- ппН2 = 6 бар x 0,79 = 4,7 бар
- ппО2 = 6 бар x 0,21 = 1,3 бар
Минимална доња граница за парцијални притисак кисеоника у смеши гасова је 0,16 бара (16 кПа) апсолутног притисака. Хипоксија и изненадни губитак свести постаје проблем када је за парцијални притисак кисеоника мањи испод 0,16 бара. Отровност кисеоника, која је повезана са грчењем, постаје проблем када је парцијални притисак превисок. Америчка организација НОАА (енгл. Натионал Оцеаниц анд Атмоспхериц Администратион) препоручује максимално излагање од 45 минута – ако је парцијални притисак кисеоника 1,6 бара (апсолутни притисак), 120 минута код парцијалног притисака кисеоника 1,5 бара, 150 минута код парцијалног притисака кисеоника 1,4 бара, 180 минута код парцијалног притисака кисеоника 1,3 бара и 210 минута код парцијалног притисака кисеоника 1,2 бара.
Наркоза азотом је проблем када је плин за дисање под високим притиском. Нормално, највећи парцијални притисак за азот је 4,5 бара и максимална дубина роњења 35 метара.
Референце[уреди | уреди извор]
- ^ Цхарлес Хенрицксон: "Цхемистрy", публисхер=Цлиффс Нотес, 2005.
- ^ „"Далтон'с Лаw оф Партиал Прессурес"”. Архивирано из оригинала 22. 12. 2008. г. Приступљено 07. 11. 2016.
- ^ „"Питтсбургх Университy цхемицал енгинееринг цласс нотес"”. Архивирано из оригинала 23. 04. 2009. г. Приступљено 07. 11. 2016.
- ^ Перрy Р.Х., Греен D.W.: "Перрy'с Цхемицал Енгинеерс Хандбоок", едитион=7тх, публисхер=МцГраw-Хилл, 1997.












