Аналог прелазног стања
Аналози прелазног стања (аналози транзиционог стања), су хемијска једињења са хемијском структуром која подсећа на прелазно стање молекула супстрата у ензимски катализованој хемијској реакцији. Ензими формирају интеракције са супстратом путем напрезања и дисторзија, чиме доводе супстрат до транзиционог стања.[1] Аналози транзиционог стања се могу користити као инхибитори ензимски катализованих реакција пошто они блокирају активно место ензима. Из теорије проистиче да би ензимски инхибитори који подсећају на структуре прелазног стања требало да се чвршће везују за ензим него сам супстрат.[2] Примери инхибитора који су аналогни прелазном стању обухватају између осталог лек против грипа из групе инхибитора неураминидаза оселтамивир и инхибитор ХИВ протеазе саквинавир који се користи у АИДС третману.
Аналог прелазног стања[уреди | уреди извор]

Прелазно стање структуре се најбоље може описати помоћу статистичке механике, при чему енергије разлагања и формирања веза имају једнаку вероватноћу кретања из прелазног стања у назад до реактаната или унапред до продуката. У ензимски катализованим реакцијама, свеукупна енргија активације реакције је нижа кад ензим стабилизује високо енергетски интермедијер прелазног стања. Аналози прелазног стања опонашају тај високо енергијски интермедијер, али не подлежу катализованој хемијској рекцији и стога се могу много јаче везати за ензим него једноставни супстрат или аналог продукта.
Дизајн аналога прелазног стања[уреди | уреди извор]
Да би се дезајнирао аналог прелазног стања, кључни корак је експериментална детерминација структуре супстрата у прелазном стању датог ензима, користећи на пример кинетички изотопни ефекат. Структура прелазног стања се исто тако може предвидети путем рачунарских приступа, што је комплементарно са КИЕ.
Кинетички изотопни ефекат[уреди | уреди извор]
Кинетички изотопни ефекат (КИЕ) је мера реакционе брзине изотопски обележеног реактанта у односу на заступљенији природни супстрат. Вредност кинетичког изотопног ефекта је однос бројева конверзија и обухвата све кораке реакције.[3] Унутрашња кинетичка вредност изотопа проистиче из разлике у вибрационом октужењу веза атома у реактантима у основном стању релативно на атоме у прелазном стању.[3] Помоћу кинетичког изотопног ефекта знатан увид се може добити о томе како прелазно стање ензимски катализоване реакције може да изгледа и то се може користи за усмеравања развоја аналога прелазног стања.
Компјутерске симулације[уреди | уреди извор]
Рачунарски приступи су корисна оруђа за елуцидацију механизма дејства ензима.[4] Сама молекулска механика не може да предвиди трансфер електрона, што је од фундаменталног значаја за органске реакције. Молекуларно динамичке симулације пружају довољно информација у погледу флексибилности протеина током каталитичке реакције. Комплементарни метод је комбинација молекуларно механичких/квантно механичких симулација (QМ/MM метод).[5] У том приступу, само атоми који су одговорни за ензиматску реакцију у каталитичком региону су обухваћени QМ приступом, док се преостали атоми третирају користећи молекуларну механику.[6]
Примери дизајна аналога прелазног стања[уреди | уреди извор]
Након одређивања структуре прелазног стања користећи било КИЕ или рачунарске симулације, инхибитор се може дизајнирати по узору на утврђене структуре прелазног стања или интермедијере. Следећа три примера илуструју како инхибитори опонашају структуре прелазног стања путем промена функционалних група које кореспондирају геометрији и електростатичкој дистрибуцији структура прелазног стања.
Инхибитор метилтиоаденозин нуклеозидазе[уреди | уреди извор]
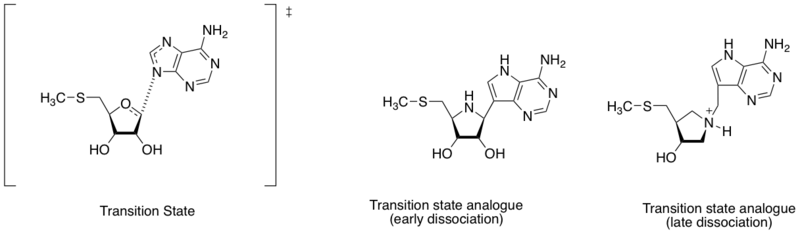
Метилтиоаденозин нуклеозидаза је ензим који катализује реакцију хидролитичке деаденилације 5'-метилтиоаденозина и С-аденосилхомоцистеина. Он се такође сматра важном метом за откривање антибактеријских лекова, јер је важан у метаболичком систему бактерија и једино се формира у њима.[7] Имајући у виду различита растојања између аденинског атома азота и рибозног аномерног угљеника (погледајте дијаграм у овој секцији), структура прелазног стања се може дефинисати по раном или касном ступњу дисоцијације. На бази налаза различих структура прелазног стања, Шрам и његови сарадници су дизајнирали аналоге два прелазна стања који опонашају рано и касно дисоцијативно прелазно стање. Аналози раног и касног прелазног стања имају афинитет везивања (Кд) од 360 и 140 пМ, респективно.[8]
Инхибитор термолизина[уреди | уреди извор]

Термолизин је ензим који катализује хидролизу пептидних амидних веза са хидрофобиним аминокиселинама, и који производи Бациллус тхермопротеолyтицус.[9] Из тог разлога, овај ензим је такође мета за дизајн антибактеријских агенаса. Ензиматски реакциони механизам започиње заменом малим пептидним молекулом молекула воде који везује цинк у близини Глу143 термолизина. Молекул воде који је активиран јоном цинак и Глу143 напада карбонилни угљеник и формира тетраедрално прелазно стање. (Погледајте слику) Холден и његови сарадници су полазећи од тог тетраедралног прелазног стања дезајнирали серије аналогних фосфонамидатних пептида. Међу синтетисаним аналозима, Р = L-Леу испољава најпотентнију инхибиторну активност (Ки = 9.1 нМ).[10]
Инхибитор аргиназе[уреди | уреди извор]
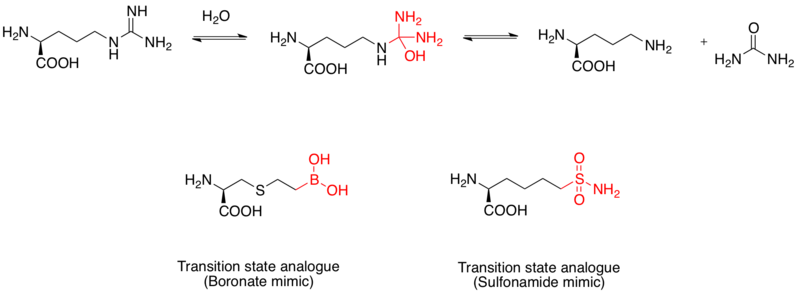
Аргиназа је бинуклеарни манганозни металопротеин који катализује хидролизу L-аргинина до L-орнитина и уреје. Она је мета за развој лекова за третман астме.[11] Механизам хидролизе L-аргинина обухвата нуклеофилни напад молекула воде, чиме се формира тетраедрални интермедијар. Студије су показале да боронска киселина може да поприми тетраедралну конфигурацију и да делује као инхибитор. Додатно, сулфонамидна функционална група може да опонаша структуру прелазног стања.[12] Евиденција да боронска киселина делује као аналог прелазног стања произилази из рендгенске кристалне структуре комплекса са људском аргиназом I.[13]
Види још[уреди | уреди извор]
- Ензим
- Структурни аналог, једињење са сличном хемијском структуром
- Инхибитор ензима
- Аналог супстрата
- Самоубилачка инхибиција
- Супстрат
Референце[уреди | уреди извор]
- ^ Силверман, Рицхард Б. (2004). Тхе Органиц Цхемистрy оф Друг Десигн анд Друг Ацтион. Сан Диего, ЦА: Елсевиер Ацадемиц Пресс. ИСБН 0-12-643732-7.
- ^ Цопеланд, Р.А.; Давис, Ј.П.; Цаин, Г.А.; Питтс, W.Ј.; Маголда, Р.L. (1996). „Тхе Иммуносуппрессиве Метаболите оф Лефлуномиде ис а Потент Инхибитор оф Хуман Дихyдрооротате Дехyдрогенасе”. Биоцхемистрy. 35 (4): 1270. дои:10.1021/би952168г.
- ^ а б Сцхрамм, Верн L> (2011). „Ензyматиц Транситион Статес, Транситион-Стате Аналогс, Дyнамицс, Тхермодyнамицс, анд Лифетимес”. Анну. Рев. Биоцхем. 80 (1): 703—732. ПМИД 21675920. дои:10.1146/аннурев-биоцхем-061809-100742.
- ^ Петер, Коллман; Кухн, Б.; Перäкyлä, M. (2002). „Цомпутатионал Студиес оф Ензyме-Цаталyзед Реацтионс: Wхере Аре Wе ин Предицтинг Мецханисмс анд ин Ундерстандинг тхе Натуре оф Ензyме Цаталyсис?”. Ј. Пхyс. Цхем. Б. 106 (7): 1537—1542. дои:10.1021/јп012017п.
- ^ Хоу, Г; Хоу, Г.; Цуи, Q. (2011). „QМ/MM Аналyсис Суггестс тхат Алкалине Пхоспхатасе (АП) анд Нуцлеотиде Пyропхоспхатасе/Пхоспходиестерасе Слигхтлy Тигхтен тхе Транситион Стате фор Пхоспхате Диестер Хyдролyсис Релативе то Солутион: Имплицатион фор Цаталyтиц Промисцуитy ин тхе АП Суперфамилy”. Ј. Ам. Цхем. Соц. 134 (1): 229—246. дои:10.1021/ја205226д.
- ^ Сцхwартз, С; Саен-оон, С.; Qуаyтман-Мацхледер, С.; Сцхрамм, V. L.; Сцхwартз, С. D. (2008). „Атомиц Детаил оф Цхемицал Трансформатион ат тхе Транситион Стате оф ан Ензyматиц Реацтион”. ПНАС. 105 (43): 16543—16545. Бибцоде:2008ПНАС..10516543С. дои:10.1073/пнас.0808413105.
- ^ Сингх, Випендер; Сингх V; Лее ЈЕ; Нúñез С; Хоwелл ПЛ; Сцхрамм ВЛ. (2005). „Транситион стате струцтуре оф 5'-метхyлтхиоаденосине/С-аденосyлхомоцyстеине нуцлеосидасе фром Есцхерицхиа цоли анд итс симиларитy то транситион стате аналогуес”. Биоцхемистрy. 44 (35): 11647—11659. ПМИД 16128565. дои:10.1021/би050863а.
- ^ Гуитиеррез, Јемy; Луо, M.; Сингх, V.; Ли, L.; Броwн, Р. L.; Норрис, Г. Е. (2007). „Пицомолар Инхибиторс ас Транситион-Стате Пробес оф 5′-Метхyлтхиоаденосине Нуцлеосидасес”. АЦС Цхемицал Биологy. 2 (11): 725—734. ПМИД 18030989. дои:10.1021/цб700166з.
- ^ С, Ендо (1962). „Студиес он протеасе продуцед бy тхермопхилиц бацтериа”. Ј. Фермент. Тецхнол. 40: 346—353.
- ^ Холден, Хазел; Тронруд, D. Е.; Монзинго, А. Ф.; Wеавер, L. Х. (1987). „Слоw-анд фаст-биндинг инхибиторс оф тхермолyсин дисплаy дифферент модес оф биндинг: црyсталлограпхиц аналyсис оф еxтендед пхоспхорамидате транситион-стате аналогс”. Биоцхемистрy. 26 (26): 8542—8553. дои:10.1021/би00400а008.
- ^ Маарсингх, Харм; Јохан Заагсма; Херман Меурс (2009). „Аргинасе: а кеy ензyме ин тхе патхопхyсиологy оф аллергиц астхма опенинг новел тхерапеутиц перспецтивес”. Бр Ј Пхармацол. 158 (3): 652—664. ПМЦ 2765587
 . ПМИД 19703164. дои:10.1111/ј.1476-5381.2009.00374.x.
. ПМИД 19703164. дои:10.1111/ј.1476-5381.2009.00374.x.
- ^ Е, Цама; Схин Х; Цхристиансон ДW. (2003). „Десигн оф амино ацид сулфонамидес ас транситион-стате аналогуе инхибиторс оф аргинасе”. Ј Ам Цхем Соц. 125 (43): 13052—7. дои:10.1021/ја036365б.
- ^ Схисхова, Екатерина; Луиги Ди Цостанзо; Давид Е. Цане; Давид W. Цхристиансон (2009). „Пробинг тхе Специфицитy Детерминантс оф Амино Ацид Рецогнитион бy Аргинасе”. Биоцхемистрy. 48 (1): 121—131. дои:10.1021/би801911в.
