Мукополисахаридоза тип I
| Мукополисахаридоза тип I | |
|---|---|
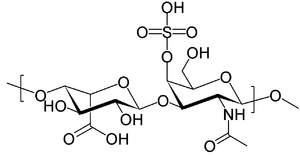 | |
| Молекул дерматан сулфата који се акумулирају у лизозомима пацијената са МПС I | |
| Узроци | недостатком ензима алфа-L-идуронидазе |
| Слична обољења | Hurler синдром; мукополисахаридоза |
| Лечење | Заменска терапија ензимима; хируршки |
| Прогноза | Смрт се обично јавља пре 12 година (Hurler синдром/ тешки облик); Животни век може бити нормалан (Scheie синдром, одређена форма) |
| Фреквенција | 1:100,0000 (Hurler синдром); 1:115,000 (Hurler-Scheie синдром); 1:500,000 (Scheie синдром)[1] |
Мукополисахаридоза тип I (скраћено МПС I) или гаргоилизам (енгл. Gargoylism),[а] једна је од преко 40 ретких наследних болести које се наслеђује аутозомно рецесивним путем, и једна од десет из групе специфичних лизосомских болести изазваних накупљањем различитих продуката у деловима ћелије познатим под називом лизозоми.
Узрокована је недостатком ензима алфа-L-идуронидазе, који доводи до немогућности разградње сложених угљених хидрата (мукополисахарида) у једноставније молекуле. Акумулација ових великих, нерегистрованих мукополисахарида у ћелијама тела узрокује бројне физичке симптоме и абнормалности.[2][3]
Најтежи облик МПС I често се назива Хурлеров синдром (скраћено МПС IH). Блажи облик МПС I се назива Scheie синдром (скраћено МПС IS), а назив Hurler-Scheie синдром (скраћено МПС I HS) понекад се примењује на међуоблик који се не уклапа ни у блажу ни у тежу категорију МПС I.
Историја
[уреди | уреди извор]Најтежи облик мукополисахаридозе тип I, који укључује замагљивање рожњаче, абнормалности скелета и менталну ретардацију, добио је назив Хурлеров синдром по немачкој педријатрици Гертруди Хурлер, која је прва описала поремећај 1919. године.[4][5]
Године 1962, амерички лекар Harold Glendon Scheie (1909–1990), идентификово је блажу варијанту Хурлеровог синдрома, МПС тип IS која је по њему названа Scheie синдром.[6]
McKusick, V. A. и сар. (1972) предложили су да се Хурлеров синдром назове — мукополисахаридоза тип I H (скраћено МПС тип I H) а Scheie синдром — мукополисахаридоза тип I S (скраћено МПС тип I S).[7]
Године 1985. Рубичек и сар. приказали су пет пацијената са недостатком алфа-Л-идуронидазе и фенотипом који је атипичан за Хурлеров синдром и Scheie синдром. Међу разним могућим објашњењима за овај фенотип, они су прихватили тумачење која се заснива на постојању генетичких варијанти за неке од случајева, које су узроковане различитим мутацијама.[8]
Епидемиологија
[уреди | уреди извор]- Учесталост
Како недостају прецизнеи подаци за инциденцу мукополисахаридоза тип I у САД, процењена инциденција је око 1 случај на 100.000 рођених.
Преваленца мукополисахаридозе тип I у Енглеској и Велсу (од 1981. до 2003. године) износила је 1,07 случајева на 100.000 рођених.[9]
- Морталитет / Морбидитет
Животни век болесника са мукополисахаридозом типа I креће се од смрти у раном детињству код најтежих облика до оне у одраслеих особа са најблажом варијантом.
- Раса
Мукополисахаридоза тип I се наслеђује аутозомним рецесивним начином и погађа оба пола.
Етиопатогенеза
[уреди | уреди извор]Мукополисахаридоза I је ретка, наследна, прогресивна, по живот опасна лизосомска болест накупљања неразграђених продуката узрокована недостатком ензима алфа-L-идуронидазе. Недостатак ензима алфа-L-идуронидазе доводи до прогресивног накупљања гликозаминогликана (скраћено ГАГ) у свим телесним ткивима, што резултујеа оштећењем функције органа, која могу бити иреверзибилна.
- Генетика
Болест се насљеђује аутозомно рецесивним путем. Односно, оба родитеља оболелога детета морају бити носиоци мутиранога гена (сваки од родитеља има један здрави и један мутирани ген). У том случају свако дете има:
- 25% шансе да оболи (ако наследи од оба родитеља мутирани ген),
- 50% је вероватно носилац једног мутираног гена и
- 25% шансе да ће бити без болести и без мутиранога гена.

Клиничка слика
[уреди | уреди извор]Клинички болест се манифестује врло разнолико, од најтежег облика познатог као Hurler-ов синдром преко нешто блажих облика позантих као Hurler-Sheie-ов синдром и Sheie-ов синдром. Укључује различити спектар симптома, тежине болести и захваћености органских система. У зависности од тога да ли је захваћен или не централни нервни систем мукополисахаридоза тип I се може окарактерисати као тешки или нешто блажи облик, али се стање код свих облика болести погоршава током времена.
У зависности од тежине симптома болести клиничка слика МПС тип I се дели у три широке групе:
Мукополисахаридоза тип I H — Hurler-ов синдром
[уреди | уреди извор]Ово је најтежи облик МПС I који се карактерише тешким и прогресивне промене попут:
- успорен ментални развој (који се погоршава током времена),
- прогресивна укоченост (контрактуре) зглобова (незапаљењска промена),
- грубе црте лица,
- деформација костура,
- срчана болест,
- манифестна инфекције горњих дисајних путева,
- повећање јетре и слезене,
- замућење рожњаче, губитак слуха.
Мукополисахаридоза тип I HS — Hurler-Sheie-ов синдром
[уреди | уреди извор]Карактерише се нормалним или скоро нормаланим менталним развојем, али са тежим телесним потешкоће од болесника који болују од Sheie-овог синдрома.
Мукополисахаридоза тип I S —Sheie-ов синдром
[уреди | уреди извор]Овај синдром карактерише:
- нормалан ментални развој,
- блаже и мање прогресивне телесна оштећења,
- дужи животни век до одрасле доби.
И код овога облика МПС I присутне су прогресивне телесне тешкоће као што су:
- прогресивна укоченост зглобова (незапаљењска),
- деформација костура,
- срчана болест,
- повремене инфекције горњег дисајних путевава,
- повећање јетре и слезине,
- замућење рожњаче,
- губитак слуха.
Дијагноза
[уреди | уреди извор]Пошто је у мукополисахаридози тип I нападнута већина органа који су код деце у фази формирања, важно је пратити све потенцијалне компликације, најмање једном годишње након потврде дијагнозе. Ови прегледи треба да укључују неуролошку процену и процену функција очију, слуха, срца, плућа, скелета и зуба. Понекад су потребни рендгенски снимци или друге додатне дијагностичке методе за извођење ових контролних испитивања.
Пренатална дијагноза
[уреди | уреди извор]Пренатална дијагноза мукополисахаридоза тип I, данас је могућа уз помоћу амниоцентезе и узорковања слоја ткива у ембриону (биопсијом хорионских ресица). Дијагноза мора бити потврђена пре 11 недеља гестације.
Диференцијална дијагноза
[уреди | уреди извор]Диференцијално дијагностички треба имати у виду следеће болести:
- Хантеров синдром (Мукополисахаридозу тип II)
- Санфилипов синдром (Мукополисахаридозу тип III)
- Morquio синдром (Мукополисахаридозу тип IV)
- Maroteaux-Lamy синдром (Мукополисахаридозу тип VI)
- Sly синдром (Мукополисахаридозу тип VII)
Терапија
[уреди | уреди извор]Лечење се спроводи заменском ензимском терапијом - хуманом рекомбинантном алфа-L-идуронидазом уз супортивне мере зависно од врсте присутних симптома, или трансплантацијом коштане сржи Најбољи резултати терапије се постижу уколико је лечење започето рано, пре наступања иреверзибилних промена.[10]
Ензимска супституциона терапија
[уреди | уреди извор]Ензимска супституциона терапија се заснива на примени хумане рекомбинантне алфа-L-идуронидазе, у недељној инфузији, како би се осигурала одговарајућа количина ензима потребна организму за побољшање укупног квалитета живота.[11][12][13][14][15][16]
Третман се показао ефикасним за побољшање фунција зглобова, функцију плућа и побољшање општег здравља. Међутим, не треба очекивати да же заменска терапија ензима да смањењи ефекате поремећаја на очим и срчаним залистцима. Такође нема доказа да се акумулација МПС супстанце у мозгу спречава или смањује, јер ензим не прелази крвно-мождану баријеру. Студије су у току како би се утврдило да ли се акумулације у кичми могу спречити применом лека директним убризгавањем у кичмену течност. Међутим за то су потребне даље студије и дуже праћење за правилну процену ефикасности терапије ензимима директно у крвоток или кичмену течност.
Симптоматска терапија
[уреди | уреди извор]Симптоматски и подржавајући третман може захтвати координиране напоре тима специјалиста:
- Педијатра (неуролога), који процењују и лечи поремећаје нервног система),
- Ортопдеда који дијагностикују и лече скелетне абнормалности
- Педијатра (кардиолога), који дијагностикују и лече срчане абнормалности
- Физиотерапеута и/или осталих здравствених радника који требају бити систематски и свеобухватно ангажовани у лечењу оболелог детета.
- Медицинске генетске, чије јсаветодавнане услуге могу бити корисне за мајке и породицу.
Терапија у истраживањима
[уреди | уреди извор]Трансплантација у гестацијском периоду
[уреди | уреди извор]Као опција код тешког облика МПС тип I може се узети у разматрање и трасплантација коштане сржи.
Трансплантације коштане сржи у утерус (енг. bone marrow transplantation (BMT)) за лечење специфичних генетских стања у гестацијском периоду, данас истражују лекари у Дечијој болници у Лос Анђелесу — применом ћелија изолованих из коштане сржи и њиховим трансплантовањем током првог триместра трудноће (пре 14 недеља гестације) у фетус са потврђеном дијагнозама;
- Wiskott-Aldrich синдром,
- хронична грануломатоза,
- алфа таласемија,
- мукополисахаридоза тип I,
- метахроматска леукодистрофија и
- Крабова болест.
Пре трансполантације дијагноза мора бити потврђена до 11 недеље гестације. Остали поремећаји складиштења мукополисахаридозе тренутно нису подобни за ову врсту студије.[17]
Замена гена
[уреди | уреди извор]Научно истраживање замене гена код животињских модела даје наду да ће терапија замене гена једног дана бити доступна особама са генетским поремећајима, као што је нпр. МПС тип I.[17]
Напомене
[уреди | уреди извор]- ^ Специфичан изглед лица детета ход Хурлеровог синдрома
Извори
[уреди | уреди извор]- ^ „Mucopolysaccharidoses Fact Sheet”. National Institute of Neurological Disorders and Stroke. 15. 11. 2017. Приступљено 23. 6. 2018.
- ^ Behrman RE, ed. Nelson Textbook of Pediatrics, 15th ed. Philadelphia, PA: W.B. Saunders Company; 1996:398-403.
- ^ Scriver CR, et al., eds. The Metabolic and Molecular Basis of Inherited Disease. 7th Ed. New York, NY; McGraw-Hill Companies, Inc; 1995:2465-85.
- ^ Hurler's syndrome на сајту Who Named It
- ^ Hurler, G. (1919). „Über einen Typ multipler Abartungen, vorwiegend am Skelettsystem”. Zeitschrift für Kinderheilkunde. Berlin. 24: 220—234.
- ^ Moore, David; Connock, Martin J.; Wraith, Ed; Lavery, Christine (1. 1. 2008). „The prevalence of and survival in Mucopolysaccharidosis I: Hurler, Hurler-Scheie and Scheie syndromes in the UK”. Orphanet Journal of Rare Diseases. 3: 24. ISSN 1750-1172. PMC 2553763
 . PMID 18796143. doi:10.1186/1750-1172-3-24.
. PMID 18796143. doi:10.1186/1750-1172-3-24.
- ^ McKusick, V. A., Howell, R. R., Hussels, I. E., Neufeld, E. F., Stevenson, R. E. Allelism, nonallelism and genetic compounds among the mucopolysaccharidoses. Lancet 299: 993-996, 1972. Note: Originally Volume I. [PubMed: 4112371, related citations] [Full Text]
- ^ Roubicek M, Gehler J, Spranger J. The clinical spectrum of alpha-L-iduronidase deficiency. Am J Med Genet. 1985 Mar;20(3):471-81.
- ^ Moore D, Connock MJ, Wraith E, Lavery C. The prevalence of and survival in Mucopolysaccharidosis I: Hurler, Hurler-Scheie and Scheie syndromes in the UK. Orphanet J Rare Dis. 2008 Sep 16. 3:24.
- ^ Muenzer J and Fisher A. Advances in the Treatment of Mucopolysaccharidosis Type I. New Engl J Med. 2004;350:1932-34.
- ^ Desnick RJ. Enzyme replacement and enhancement therapies for lysosomal diseases. J. Inherit Metab Dis. 2004;27:385-410.
- ^ Wraith JE, Clarke LA, Beck M, et al. Enzyme replacement therapy for mucopolysaccharidosis I: a randomized, double-blinded, placebo-controlled, multinational study of recombinant human alpha-L-iduronidase (laronidase). J Pediatr. 2004;144:581-88.
- ^ Malm G, et al., Mucopolysaccharidoses. New therapeutic possibilities increase the need of early diagnosis. Lakartidningen. 2002;99:1804-9
- ^ Kakkis ED, Enzyme replacement therapy for the mucopolysaccharides storage disorders. Expert Opin Investig Drugs. 2002;11:675-85.
- ^ Wraith JE, Enzyme replacement therapy in mucopolysaccharidosis type I: progress and emerging difficulties. J Inherit Metab Dis. 2001;24:245-50.
- ^ Kakkis ED, et al., Enzyme-replacement therapy in mucopolysaccharidosis I. N Engl J Med. 2001;344:182-8.
- ^ а б Investigational Therapies, У: Мucopolysaccharidosis Type I National Organization for Rare Disorders (NORD)
Литература
[уреди | уреди извор]- Fauci AS, et al., eds. Harrison’s Principles of Internal Medicine, 14th Ed. New York, NY: McGraw-Hill, Inc; 1998:2169-76.
- Beighton P, ed. Mckusick’s Heritable Disorders of Connective Tissue. 5th ed. St. Louis, MO: Mosby-Year Book, Inc; 1993:1118-9.
- Eto Y, Ohashi T, Gene therapy/cell therapy for lysosomal storage disease. J Inherit Metab Dis. 2000;293-8.
- Triggs-Raine B, et al., Mutations in HYAL1, a member of a tandemly distributed multigene family encoding disparate hyaluronidase activities, cause a newly described lysosomal disorder, mucopolysaccharidosis IX. Proc Natl Acad Sci USA. 1999;95:6296-300.
- Natowicz MR, et al., Clinical biochemical manifestations of hyaluronidase deficiency. N Engl J Med. 1996;335:1029-33.
- Herrick IA, et al., The mucopolysaccharidoses and anaesthesia: a report of clinical experience. Can J Anaesth. 1988;35:67-73.
- Sjogren P, et al., Mucopolysaccharidoses and anaesthetic risks. Acta Anaesthesiol Scand. 1987;31:214-8.
- Caruso RC, et al., Electroretinographic findings in the mucopolysaccharidoses. Ophthalmology. 1986;93::1612-6.
Спољашње везе
[уреди | уреди извор]- Mucopolysaccharidoses Types I-VII (језик: енглески)
- Mucopolysaccharidoses Fact Sheet (језик: енглески)
 | Молимо Вас, обратите пажњу на важно упозорење у вези са темама из области медицине (здравља). |
