Комбинаторна хемија
Комбинаторна хемија се састоји од хемијских синтетичких метода који омогућавају припрему великог броја (десетина до хиљада или чак милиона) једињења у појединачном процесу. Колекције једињења се могу састојати од смеша, сетова појединачних једињења или хемијских структура формираних помоћу рачунарског софтвера. Комбинаторна хемија се може користити за синтезу малих молекула и пептида.
Стратегије које омогућавају идентификацију корисних једињења у колекцијама су исто тако део комбинаторне хемије. Методи који се користе у комбинаторној хемији се такође користе изван хемије.
Увод[уреди | уреди извор]
Синтеза молекула у комбинаторном маниру може брзо да доведе до великог броја молекула. На пример, молекул са три тачке разноврсности (Р1, Р2, и Р3) може да формира могућих структура, где су , , и бројеви различитих супституената.
Основни принцип комбинаторне хемије је да се припреме колекције са веома великим бројем једињења, и да се затим идентификују корисна једињења у колекцијама.
Мада је комбинаторна хемија била у индустријској примени тек од 1990-тих, њени корени досежу до 1960-тих, кад је истраживач са Рокфелеровог универзитета, Брус Мерифилд, започео испитивање синтезе пептида у чврстој фази.
У њеној модерној форми, комбинаторна хемија је вероматно извршила највећи утицај у фармацеутској индустрији. Истраживачи који раде на оптимизацији профила активности једињења креирају 'колекцију' са мноштвом различитих али сродних једињења. Напредак роботике је довео до индустријског приступа комбинаторној синтези, омогућавајући рутинску припрему колекција са преко 100.000 нових једињења годишње.
Да би могли да рукују тако великим бројем структурних могућности, истраживачи често креирају 'виртуалну колекцију', рачунарску енумерацију свих могућих структура датог фармакофора са свим доступним реактантима.[1] Таква колекција се може састојати од стотина милиона 'виртуалних' једињења. Истраживачи одабирају подсет 'виртуалне колекције' за стварну синтезу на бази разних прорачуна и критерија (погледајте АДМЕ, рачунарска хемија, и QСАР).
Комбинаторна синтеза пептида[уреди | уреди извор]
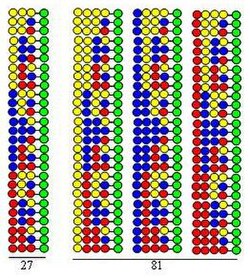
Комбинаторна “синтеза поделе и мешања”[2] је базирана на синтези чврсте фазе коју је развио Мерифилд.[3] Ако се комбинаторна пептидна колекција синтетише користећи 20 аминокиселина (или других типова градивних блокова) зрнца која дају чвсту подршку се деле у 20 једнаких порција. Томе следи спајања различитих аминокиселина у свакој порцији. Трећи корак је мешање свих порција. Та три корака сачињавају циклус. Елонгација пептидних ланаце се може остварити путем једноставног понављања корака циклуса.

Процедура је илустрована синтезом дипептидне колекције користећи исте три аминокиселине као градивне блокове у два циклуса. Свака компонента те колекције садржи две аминокиселине уређене у различитом редоследима. Аминокиселине које се користе у спаривању су представљене жутим, плавим и црвеним круговима на слици. Дивергентне стрелице означавају поделе резина чврсте подлоге (зелени кругови) у једнаке пропорције, вертикалне стрелице означавају спрезање и конвергентне стрелице престављају мешање и хомогенизирање порција подлоге.
Слика приказује да се у два синтетичка циклуса формира 9 дипептида. У трећем и четвртом циклусу 27 трипептида и 81 тетрапептида би се формирало, респективно.
Синтеза “поделе и мешања” има неколико изузетних својстава:
- Она је високо ефикасна. Као што слика демонстрира број пептида формираних у синтетичком процесу (3, 9, 27, 81) се експоненцијално повећава са бројем извршених циклуса. Користећи 20 аминокиселине у сваком синтетичком циклусу број формираних пептида је: 400, 8,000, 160,000 и 3,200,000, респективно.
- Све пептидне секвенце се формирају у процесу који се може извести комбинацијом аминокиселина кориштених у циклусима.
- Раздељивање подлоге у једнаке узорке осигурава формирање компоненти колекције у приближно једнаким моларним квантитетима.
- Само се један пептид формира на сваком зрнцу подлоге. То је последица употребе само једне аминокиселине у корацима формирања спрега. Међутим није познато који пептид окупира које зрнце.
- Метод поделе и мешања се може користити за синтезу органских или било које друге врсте колекције која се може припремити из градивних блокова постепеним процесом.
Године 1990, три групе су описале методе за припрему пептидних колекција биолошким методима[4][5][6] и годину дана касније Фодор ет ал. су објавили изванредан метход за синтезу пептидних низова на малим стакленим плочицама.[7]
Метод “паралелне синтезе” је развио Марио Геyсен са сарадницима ради припреме пептидних низова.[8] Они су синтетисали 96 пептида на пластичним штапићима (иглама) обложеним на крајевима чврстом подлогом. Игле су уроњене у раствор реагенса смештеног у отворима микротитрационе плоче. Метод је нашао широку примену посебно уз употребу аутоматских паралелних синтетизера. Мада је паралелни метод знатно спорији од комбинаторног, његова предност је да је познато који пептид или друго једињење се формира на свакој игли.
Даље процедуре којима се комбинују предности метода поделе и мешања са паралелном синтезом су развијене. У методу који су описале две групе[9][10] чврста подлога је смештена у пермеабилне пластичне капсуле заједно са радиофреквентном ознаком која означава једињење које ће се формирати у капсули. Примењује се процедура која је слична са методом поделе и мешања. Међутим у кораку поделе капсуле Се расподељују међу реакционим посудама на бази кода радиофреквентних ознака капсула.
Различити метод са истом наменом су развили Фурка ет ал.[11] Метод се назива низна синтеза (енгл. string synthesis). У овом методу капсуле немају код. Оне су нанизане као бисери огрлице и стављају се у реакционе судове у нанизаној форми. Идентитет капсула, као и њихов садржај, су познати на основу њихове позиције у низу. Након неколико корака спрезања капсуле се расподељују међу новим низовима на основу дефинисаних правила.
Деконволуција и скрининг[уреди | уреди извор]
Синтетисани молекули комбинаторне колекције се одвајају од чврсте подлоге и мешају у раствору. У таквом раствору се налазе милиони различитих једињења. Кад је овај синтетички приступ развијен, у почетку је изгледало немогуће да се идентификују молекули, и да се нађу они који имају корисна својства. Стратегије пречишћавања, идентификације, и скрининга су накнадно развијене да би се решио проблем. Све те стратегије су базиране на синтези и тестирању парцијалних колекција.
Најранија стратегија, “итеративни метод” је описана у горе поменутом документу који је Фурка написао 1982. Идентификација секвенци активног пептида обухавата узимање узорка након сваког синтетичког корака пре мешања. Ови узорци се користе у корак по корак идентификацији тестирањем и купловањем полазећи од Н-терминуса.
Метод “позиционог скенирања”[12] је базиран на синтези и тестирању серије потколекција у којима је дата позиција секвенце у свим компонентама заузета истом аминокиселином.
“Изоставне колекције”[13][14] у којима дате аминокиселине недостаје у свим пептидима смеше, као и “аминокиселинске тест колекције”[15] које садрже пептиде који недостају у изоставним колекцијама се исто тако могу користити у процесу деконволуције.
Ако пептиди нису одвојени од чврсте подлоге ради се смешама гранула, при чему свака гранула садржи један пептид. Смит и његови сарадници[16] су показали да се пептиди могу тестирати у везаној форми. Овај приступ исто тако користи скрининг пептидних колекција.[17] Колекција везаних пептида се тестира раствореним циљним протеином. Грануле за које су везани протеини се издвоје; протеин се одвоји од гранула и затим се идентификује секвенцирањем.
Донекле различит приступ су произвели Тејлор и Моркен.[18] Они су користили инфрацрвену термографију да идентификују катализаторе код непептидних фиксиранх колекција. Кад су грануле уроне у раствор супстрата, грануле које садрже катализатор су сијају због топлоте која се ослобођена у њима, те су могу одвојити.
Компоненте комбинаторне колекције се исто тако могу тестирати једна по једна након одвајања од појединачних гранула.
Кад се ради са непептидном органским колекцијама, није једноставно да се одреди идентитет садржаја грануле као што је то случај са пептидима. Да би се превазишла ова потешкоћа развијени су методи за фиксирање на гранулама паралелно са синтезом колекције, при чему се молекули који кодирају идентитет једињењана формирању у гранули. Фиксирани молекули могу да формирају пептидне[19][20] или нуклеотидне[21][19] секвенце или бинарни код.[22]
Наука о материјалима[уреди | уреди извор]
Технике комбинаторне хемије су нашле примену у науци о материјалима. Пионирске доприносе су направили П.Г. Шултц ет ал. током деведесетих[23] у контексту луминесцентних материјала добијених путем кодепозиције елемената на силицијумском супстрату. Његовом раду је предходовао допринос Ј. Ј. Ханака 1970. године[24] мада рачунарска и роботичка оруђа нису била доступна тако да метод није нишао ширу примену у то време. Рад је наставило неколико академских група[25][26][27][28] као и компаније са великим истраживачким и развојним програмима (Сyмyx Тецхнологиес, ГЕ, Доw Цхемицал етц.). Техника је екстензивно кориштена за катализу,[29] премазе,[30] електронику,[31] као и у многим другим пољима.[32] Примјена одговарајућих информатичких алата је критична за руковање, администрацију, и складиштење огромне количине произведених података.[33] Нови типови метода дизајна експеримената су такође развијени да би се ефикасно адресирали велики експериментални простори који су доступни користећи комбинаторне методе.[34]
Разноврснот хемијских колекција[уреди | уреди извор]
Мада је комбинаторна хемија била есенцијални део раних истраживања лекова током периода који премашује две декаде, до сада је само једна де ново комбинаторно хемијски синтетисана хемикалија одобрена за клиничку употребу од стране ФДА (сорафениб, мултикиназни инхибитор који се користи у третману напредне фазе рака бубрега).[35] Анализа ниске стопе успешности овог приступа сугерише да је један од разлога знатна ограниченост хемијског простора који је покривен продуктима комбинаторне хемије.[36] При упоређивању својстава једињења комбинаторних хемијских колекција са својствима одобрених лекова и природних продуката, Фехер и Шмидт[36] су уочили да комбинаторне хемијске колекције имају низак степен хиралности и структурне ригидности, што је у супротности са својствима лекова. Мада природни продукти нису задњих догина били популарни у пољу развоја лекова, знатна пропорција нових хемијских ентитета су још увек једињења изведена из природних продуката, и стога се сматра да би ефективност комбинаторне хемије могла да се побољша повећањем хемијске разноврстности колекција за скрининг.[37]
Патентна класификациона подкласа[уреди | уреди извор]
У 8. издању Међународне патентне класификације (ИПЦ), које је ступило на снагу 1. јануара 2006, специјална поткласа је креирана за патентне апликације и патенте везане за испитивања у домену комбинаторне хемије: "Ц40Б".
Види још[уреди | уреди извор]
- Комбинаторика
- Хеминформатика
- Комбинаторна биологија
- Откривање лекова
- Динамичка комбинаторна хемија
- Високопропусни скрининг
- Математичка хемија
- Молекулско моделовање
Референце[уреди | уреди извор]
- ^ Гордеева, Екатерина V.; Лусхникнов, Дмитри Е.; Зефиров, Николаи С. (1992). „ЦОМПАСС Програм - ан Оригинал Семи-Емперицал Аппроацх то Цомпутер-Ассистед Сyнтхесис”. Тетрахедрон. 48 (18): 3789—3804. дои:10.1016/С0040-4020(01)92270-7.
- ^ Á. Фурка, Ф. Себестyен, M. Асгедом, Г. Дибо, Генерал метход фор рапид сyнтхесис оф мултицомпонент пептиде миxтурес. Инт. Ј. Пептиде Протеин Рес., 1991, 37, 487-493.
- ^ Меррифиелд РБ, 1963 Ј. Ам. Цхем. Соц. 85, 2149.
- ^ Ј. К. Сцотт анд Г. П. Смитх Сциенце 1990, 249, 404.
- ^ С. Цwирла, Е. А. Петерс, Р. W. Барретт анд W. Ј. Доwер Проц. Натл. Ацад. Сци. УСА 1990, 87, 6378.
- ^ Ј. Ј. Девлин, L. C. Панганибан анд П. Е. Девлин Сциенце 1990, 249, 404.
- ^ Фодор СП, Реад ЈЛ, Пиррунг MC, Стрyер L, Лу АТ, Солас D, 1991. Лигхт-дирецтед, спатиаллy аддрессабле параллел цхемицал сyнтхесис. Сциенце 251, 767-73.
- ^ Х. M. Геyсен, Р. Х. Мелоен, С. Ј. Бартелинг Проц. Натл. Ацад. Сци. УСА 1984, 81, 3998.
- ^ Е. Ј. Моран, С. Сарсхар, Ј. Ф. Царгилл, M. Схахбаз, А Лио, А. M. M. Мјалли, Р. W. Армстронг Ј. Ам. Цхем. Соц. 1995, 117, 10787.
- ^ К. C. Ницолаоу, X –Y. Xиао, З. Парандоосх, А. Сенyеи, M. П. Нова Ангеw. Цхем. Инт. Ед. Енгл. 1995, 36, 2289.
- ^ Á. Фурка, Ј. W. Цхристенсен, Е. Хеалy, Х. Р. Таннер, Х. Санеии Ј. Цомб. Цхем. 2000, 2, 220.
- ^ Á. Фурка, Ф. Себестyéн WО 93/24517.
- ^ Т. Царелл, Е. А. Wинтер, Ј. Ребек Јр. Ангеw. Цхем. Инт. Ед. Енгл. 1994, 33, 2061.
- ^ Е. Цâмпиан, M. Петерсон, Х. Х. Санеии, Á. Фурка Биоорг. & Мед. Цхем. Леттерс 1998, 8, 2357.
- ^ Е. Цâмпиан, Ј. Цхоу, M. L. Петерсон, Х. Х. Санеии, Á. Фурка, Р. Рамаге, Р. Ептон (Едс) Ин Пептидес 1996, 1998, Маyфлоwер Сциентифиц Лтд. Енгланд, 131.
- ^ Ј. А. Смитх Ј. Г. Р. Хуррел, С. Ј. Леацх Иммуноцхемистрy 1977, 14, 565.
- ^ К. С. Лам, С. Е. Салмон, Е. M. Херсх, V. Ј. Хрубy, W. M. Казмиерски, Р. Ј. Кнапп Натуре 1991, 354, 82; анд итс цоррецтион: К. С. Лам, С. Е. Салмон, Е. M. Херсх, V. Ј. Хрубy, W. M. Казмиерски, Р. Ј. Кнапп Натуре 1992, 360, 768.
- ^ С. Ј. Таyлор, Ј. П. Моркен Сциенце 1998, 280, 267.
- ^ а б Ј. Ниелсен, С. Бреннер, К. D. Јанда Ј. Ам. Цхем. Соц. 1993, 115, 9812.
- ^ V. Николаиев, А. Стиерандова, V. Крцхнак, Б. Селигман, К. С. Лам, С. Е. Салмон, M. Лебл Пепт. Рес. 1993, 6, 161.
- ^ С. Бреннер анд Р. А. Лернер Проц. Натл. Ацад. Сци. УСА 1992, 89, 5381.
- ^ M. Х. Ј. Охлмеyер, Р. Н. Сwансон, L. W. Диллард, Ј. C. Реадер, Г. Асоулине, Р. Кобаyасхи, M. Wиглер, W. C. Стилл Проц. Натл. Ацад. Сци. УСА 1993, 90, 10922.
- ^ X. -D. Xианг ет ал. "А Цомбинаториал Аппроацх то Материалс Дисцоверy" Сциенце 268 (1995) 1738
- ^ Ј.Ј. Ханак, Ј. Матер. Сци, 1970, 5, 964-971
- ^ Цомбинаториал метходс фор девелопмент оф сенсинг материалс, Спрингер. 2009. ISBN 978-0-387-73712-6.
- ^ V. M. Мирскy, V. Куликов, Q. Хао, О. С. Wолфбеис. Мултипараметер Хигх Тхроугхпут Цхарацтеризатион оф Цомбинаториал Цхемицал Мицроарраyс оф Цхемосенситиве Полyмерс. Мацромолец. Рап. Цомм., 2004, 25, 253-258
- ^ Коинума, Х.; Аиyер, Х.Н.; Матсумото, Y. (2000). „Цомбинаториал солид стате материалс сциенце анд тецхнологy”. Сциенце анд Тецхнологy оф Адванцед Материалс. 1 (1): 1—10. Бибцоде:2000СТАдМ...1....1К. С2ЦИД 137661433. дои:10.1016/С1468-6996(00)00003-6.
- ^ Мардаре, Андреи Ионут; Yадав, Амар Прасад; Wиецк, Андреас Дирк; Стратманн, Мартин; Хассел, Ацхим Wалтер (2008). „Цомбинаториал елецтроцхемистрy он Ал–Фе аллоyс”. Сциенце анд Тецхнологy оф Адванцед Материалс. 9 (3): 035009. Бибцоде:2008СТАдМ...9ц5009И. ПМЦ 5099663
 . ПМИД 27878006. дои:10.1088/1468-6996/9/3/035009.
. ПМИД 27878006. дои:10.1088/1468-6996/9/3/035009.
- ^ Апплиед Цаталyсис А, Волуме 254, Иссуе 1, Пагес 1-170 (10 Новембер 2003)
- ^ , Ј. Н. Цаwсе ет. ал, Прогресс ин Органиц Цоатингс, Волуме 47, Иссуе 2, Аугуст 2003, Пагес 128-135
- ^ Цомбинаториал Метходс фор Хигх-Тхроугхпут Материалс Сциенце, МРС Процеедингс Волуме 1024Е, Фалл 2007
- ^ Цомбинаториал & Артифициал Интеллигенце Метходс ин Материалс Сциенце II, МРС Процеедингс Волуме 804, Фалл 2004
- ^ QСАР & Цомбинаториал Сциенце, 24, Нумбер 1 (Фебруарy 2005)
- ^ Ј. Н. Цаwсе, Ед., Еxпериментал Десигн фор Цомбинаториал анд Хигх Тхроугхпут Материалс Девелопмент, Јохн Wилеy анд Сонс, 2002.
- ^ Неwман, Давид Ј.; Црагг, Гордон M. (2007). „Натурал Продуцтс ас Соурцес оф Неw Другс овер тхе Ласт 25 Yеарс”. Јоурнал оф Натурал Продуцтс. 70 (3): 461—477. ПМИД 17309302. дои:10.1021/нп068054в.
- ^ а б M. Фехер анд Ј. M. Сцхмидт "Пропертy Дистрибутионс: Дифференцес бетwеен Другс, Натурал Продуцтс, анд Молецулес фром Цомбинаториал Цхемистрy" Ј. Цхем. Инф. Цомпут. Сци., 43 (2003) 218
- ^ Су QБ, Беелер АБ, Лобковскy Е, Порцо ЈА, Панек ЈС "Стереоцхемицал диверситy тхроугх цyцлодимеризатион: Сyнтхесис оф полyкетиде-лике мацродиолидес." Орг Летт 2003, 5:2149-2152.
Спољашње везе[уреди | уреди извор]
- Енглисх версион оф тхе 1982 доцумент
- “Тхе цонцеалед сиде оф тхе хисторy оф цомбинаториал цхемистрy”
- ИУПАЦ'с "Глоссарy оф Термс Усед ин Цомбинаториал Цхемистрy"
- АЦС Цомбинаториал Сциенце (формерлy Јоурнал оф Цомбинаториал Цхемистрy)
- Цомбинаториал Цхемистрy Ревиеw
- Молецулар Диверситy
- Цомбинаториал Цхемистрy анд Хигх Тхроугхпут Сцреенинг
- Цомбинаториал Цхемистрy: ан Онлине Јоурнал
- СмиЛиб - А фрее опен-соурце софтwаре фор цомбинаториал либрарy енумератион
- ГЛАРЕ - А фрее опен-соурце софтwаре фор цомбинаториал либрарy десигн




