Тример (хемија)
У хемији, тример је молекул или полиатомски ањон настао комбинацијом или асоцијацијом три молекула или јона исте супстанце. У техничком жаргону, тример је врста олигомера добијеног од три идентична прекурзора често у конкуренцији са полимеризацијом.
Примери[уреди | уреди извор]
Алкинска тримеризација[уреди | уреди извор]

Године 1866, Марцелин Бертело је известио о првом примеру циклотримеризације, претварања ацетилена у бензен.[1] Овај процес је комерцијализован:
Тримеризација нитрила[уреди | уреди извор]
Симетрични 1,3,5-триазини се добијају тримеризацијом одређених нитрила као што је цијаноген хлорид.
Цијаноген хлорид и цијаноген бромид се тримеризују на повишеним температурама преко угљеничног катализатора.[1] Хлорид даје цијанурични хлорид:
Бромид има продужени рок трајања када се чува у фрижидеру. Као и хлорид, он се подвргава аб егзотермној тримеризацији да би се формирао цијанурични бромид. Ову реакцију катализују трагови брома, металних соли, киселина и база.[2] Из тог разлога, експериментатори избегавају браонасте узорке.[3]
Индустријски пут до цијанурске киселине подразумева термичко разлагање урее, уз ослобађање амонијака. Конверзија почиње на приближно 175 °Ц:[4]
Ендотермна синтеза меламина може се разумети у два корака.
Прво, уреа се разлаже на изоцијанску киселину и амонијак у ендотермној реакцији:
Затим у другом кораку, изоцијанска киселина се полимеризује да би се формирала цијанурска киселина, која се кондензује са ослобођеним амонијаком из првог корака да би ослободио меламин и вода.
Ова вода затим реагује са присутном изоцијанском киселином, која помаже у покретању реакције тримеризације, стварајући угљен-диоксид и амонијак.
Други корак је егзотерман:
али је укупан процес ендотерман.
Диенска тримеризација[уреди | уреди извор]
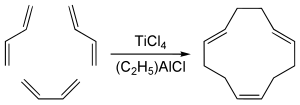
1,5,9-транс-транс-цис изомер циклододекатриена, који има одређени индустријски значај, добија се циклотримеризацијом бутадиена са титанијум тетрахлоридом и органоалуминијумским кокатализатором:[5]
Разлагање угљеник-хетеро двоструких веза уз формирање симетричних засићених 1,3,5-хетероцикличних једињења[уреди | уреди извор]
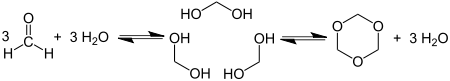
Циклотримеризација формалдехида даје 1,3,5-триоксан:
1,3,5-тритиан је циклични тример иначе нестабилне врсте тиоформалдехида. Ово хетероциклично једињење се састоји од шесточланог прстена са наизменичним метиленским мостовима и тиоетарским групама. Припрема се третирањем формалдехида водоник-сулфидом.[6]
Три молекула ацеталдехида се кондензују и формирају паралдехид, циклични тример који садржи C-О једноструке везе.
Катализација и дехидратација сумпорном киселином, тримеризација ацетона преко алдолне кондензације даје мезитилен[7]
Трисилоксани[уреди | уреди извор]
Диметилсиландиол дехидрира до тримера Ме
2СиО као и полидиметилсилоксан. Реакција илуструје конкуренцију између тримеризације и полимеризације. Полимер и тример су формално изведени из хипотетичког сила-кетона Ме
2Си=О, иако ова врста није интермедијер.
Координациона хемија[уреди | уреди извор]

2ЦПх)
2]
3.
Дитиобензоатни комплекси [M(С
2ЦПх)
2] кристалишу као тримери (M = Ни, Пд).[8]
Види још[уреди | уреди извор]
Референце[уреди | уреди извор]
- ^ а б Хиллис О. Фолкинс (2005). „Бензене”. Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy. Wеинхеим: Wилеy-ВЦХ. ИСБН 3527306730. дои:10.1002/14356007.а03_475.
- ^ Моррис, Јоел; Ковáцс, Лајос; Охе, Коуицхи (2015). „Цyаноген Бромиде”. Енцyцлопедиа оф Реагентс фор Органиц Сyнтхесис. стр. 1—8. ИСБН 9780470842898. дои:10.1002/047084289X.рц269.пуб3.
- ^ Јоел Моррис; Лајос Ковáцс (2008). „Цyаноген Бромиде”. Енцyцлопедиа оф Реагентс фор Органиц Сyнтхесис. ИСБН 978-0471936237. дои:10.1002/047084289X.рц269.пуб2.
- ^ Клаус Хутхмацхер, Диетер Мост "Цyануриц Ацид анд Цyануриц Цхлориде" Уллманн'с Енцyцлопедиа оф Индустриал Цхемистрy" 2005, Wилеy-ВЦХ, Wеинхеим. дои 10.1002/14356007.а08 191
- ^ Индустриал Органиц Цхемистрy, Клаус Wеиссермел, Ханс-Јурген Арпе Јохн Wилеy & Сонс; 3рд 1997 ISBN 3-527-28838-4
- ^ Бост, Р. W.; Цонстабле, Е. W. "сyм-Тритхиане" Органиц Сyнтхесес, Цоллецтед Волуме 2, п.610 (1943). „Арцхивед цопy” (ПДФ). Архивирано из оригинала (ПДФ) 2012-03-29. г. Приступљено 2014-05-05.
- ^ Цумминг, W. M. (1937). Сyстематиц органиц цхемистрy (3Е). Неw Yорк, УСА: D. Ван Ностранд Цомпанy. стр. 57.
- ^ Бонамицо, M.; Дессy, Г.; Фарес, V.; Сцарамузза, L. (1975). „Струцтурал Студиес оф Метал Цомплеxес wитх Сулпхур-Цонтаининг Бидентате Лигандс. Парт I. Црyстал анд Молецулар Струцтурес оф Тримериц Бис-(дитхиобензоато)-ницкел(II) анд -палладиум(II)”. Јоурнал оф тхе Цхемицал Социетy, Далтон Трансацтионс (21): 2250—2255. дои:10.1039/ДТ9750002250.




![{\displaystyle {\ce {3 H2N-CO-NH2 -> [C(O)NH]3 + 3 NH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6de156d81639cf3dcee9ba7233f13135ba2bfa91)
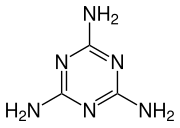

![{\displaystyle {\ce {3 HOCN -> [C(O)NH]3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6a34f3b03c3ba201baf55fca465c07bf72526c7)
![{\displaystyle {\ce {[C(O)NH]3 + 3 NH3 -> C3H6N6 + 3 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/622a370fe2c00b97f4012e0e3294ddc0741bcc0f)